يتطلب مفهوم "حلقة البنزين" فك التشفير على الفور. للقيام بذلك، من الضروري على الأقل النظر لفترة وجيزة في بنية جزيء البنزين. تم اقتراح الهيكل الأول للبنزين في عام 1865 من قبل العالم الألماني أ. كيكولي:
وتشمل الهيدروكربونات العطرية الأكثر أهمية البنزين C 6 H 6 ومتجانساته: التولوين C 6 H 5 CH 3، الزيلين C 6 H 4 (CH 3) 2، وما إلى ذلك؛ النفثالين C10H8 والأنثراسين C14H10 ومشتقاتهما.
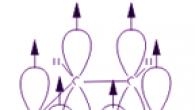
تشكل ذرات الكربون الموجودة في جزيء البنزين شكلا سداسيا مسطحا منتظما، على الرغم من أنه عادة ما يتم رسمه على شكل مستطيل.
تم تأكيد بنية جزيء البنزين أخيرًا من خلال تفاعل تكوينه من الأسيتيلين. تصور الصيغة الهيكلية ثلاث روابط كربون-كربون مفردة وثلاثية مزدوجة بالتناوب. لكن مثل هذه الصورة لا تنقل البنية الحقيقية للجزيء. في الواقع، روابط الكربون-كربون في البنزين متكافئة، ولها خصائص تختلف عن تلك الموجودة في الروابط الفردية أو المزدوجة. يتم تفسير هذه الميزات من خلال التركيب الإلكتروني لجزيء البنزين.
الهيكل الإلكتروني للبنزين
كل ذرة كربون في جزيء البنزين تكون في حالة تهجين sp2. وهو متصل بذرتي كربون مجاورتين وذرة هيدروجين بثلاث روابط σ. والنتيجة هي مسدس مسطح: جميع ذرات الكربون الست وجميع الروابط C-C وCH تقع في نفس المستوى. السحابة الإلكترونية للإلكترون الرابع (p-electron)، والتي لا تشارك في التهجين، لها شكل الدمبل وموجهة بشكل عمودي على مستوى حلقة البنزين. تتداخل هذه السحب الإلكترونية من ذرات الكربون المجاورة فوق مستوى الحلقة وتحته.

ونتيجة لذلك، تشكل ستة إلكترونات p سحابة إلكترونية مشتركة ورابطة كيميائية واحدة لجميع ذرات الكربون. توجد منطقتان من مستوى الإلكترون الكبير على جانبي مستوى الرابطة σ.

تتسبب سحابة الإلكترون p في تقليل المسافة بين ذرات الكربون. في جزيء البنزين هما متساويان ويساويان 0.14 نانومتر. في حالة الرابطة الفردية والمزدوجة، ستكون هذه المسافات 0.154 و0.134 نانومتر، على التوالي. وهذا يعني أنه لا توجد روابط مفردة أو مزدوجة في جزيء البنزين. جزيء البنزين عبارة عن دورة مستقرة مكونة من ستة أعضاء من مجموعات CH متطابقة تقع في نفس المستوى. جميع الروابط بين ذرات الكربون في البنزين متكافئة، وهو ما يحدد الخصائص المميزة لحلقة البنزين. وينعكس هذا بدقة أكبر في الصيغة البنائية للبنزين على شكل مسدس منتظم بداخله دائرة (I). (ترمز الدائرة إلى تكافؤ الروابط بين ذرات الكربون.) ومع ذلك، غالبًا ما تُستخدم صيغة كيكولي التي تشير إلى الروابط المزدوجة (II):

تحتوي حلقة البنزين على مجموعة معينة من الخصائص، والتي تسمى عادة العطرية.
سلسلة متجانسة، الايزومرية، التسميات
تقليديا، يمكن تقسيم الساحات إلى صفين. الأول يشمل مشتقات البنزين (على سبيل المثال، التولوين أو ثنائي الفينيل)، والثاني يشمل الأرينات المكثفة (متعددة النوى) (أبسطها هو النفثالين):

سلسلة البنزين المتماثلة لها الصيغة العامة C n H 2 n -6. يمكن اعتبار المتجانسات مشتقات بنزين يتم فيها استبدال ذرة هيدروجين واحدة أو أكثر بجذور هيدروكربونية مختلفة. على سبيل المثال، C 6 H 5 -CH 3 - ميثيل بنزين أو تولوين، C 6 H 4 (CH 3) 2 - ثنائي ميثيل بنزين أو زيلين، C 6 H 5 -C 2 H 5 - إيثيل بنزين، إلخ.

وبما أن جميع ذرات الكربون في البنزين متكافئة، فإن متجانسه الأول، التولوين، لا يحتوي على أيزومرات. يحتوي المتماثل الثاني، ثنائي ميثيل بنزين، على ثلاثة أيزومرات تختلف في الترتيب النسبي لمجموعات الميثيل (البدائل). هذا هو أيزومر أورثو (مختصر o-)، أو 1،2، حيث توجد البدائل على ذرات الكربون المجاورة. إذا كانت البدائل مفصولة بذرة كربون واحدة، فهي ميتا- (يختصر m-) أو 1،3-أيزومر، وإذا كانت مفصولة بذرتي كربون، فهي شبه- (يختصر p-) أو 1,4-أيزومر. في الأسماء، يتم تعيين البدائل بالحروف (o-، m-، p-) أو الأرقام.

الخصائص الفيزيائية
الأعضاء الأولون في سلسلة البنزين المتجانسة هم سوائل عديمة اللون ذات رائحة معينة. كثافتها أقل من 1 (أخف من الماء). غير قابلة للذوبان في الماء. يعتبر البنزين ومماثلاته في حد ذاته مذيبات جيدة للعديد من المواد العضوية. تحترق الساحات بلهب دخاني بسبب ارتفاع نسبة الكربون في جزيئاتها.
الخصائص الكيميائية
تحدد العطرية الخواص الكيميائية للبنزين ومماثلاته. يعتبر نظام π ذو ستة إلكترونات أكثر استقرارًا من روابط π العادية ثنائية الإلكترون. لذلك، تكون تفاعلات الإضافة أقل شيوعًا بالنسبة للهيدروكربونات العطرية مقارنة بالهيدروكربونات غير المشبعة. التفاعلات الأكثر تميزًا للأرين هي تفاعلات الاستبدال. وهكذا فإن الهيدروكربونات العطرية تحتل في خواصها الكيميائية موقعا وسطا بين الهيدروكربونات المشبعة وغير المشبعة.
I. ردود الفعل الاستبدال
1. الهلجنة (مع Cl2,Br2)

2. النتروجين

3. السلفنة

4. الألكلة (تتشكل متجانسات البنزين) - تفاعلات فريدل- كرافتس

تحدث ألكلة البنزين أيضًا عندما يتفاعل مع الألكينات:

يتم الحصول على الستايرين (فينيل بنزين) عن طريق نزع الهيدروجين من إيثيل بنزين:

ثانيا. تفاعلات الإضافة
1. الهدرجة

2. الكلورة

ثالثا. تفاعلات الأكسدة
1. الاحتراق
2C6H6 + 15O2 → 12CO2 + 6H2O
2. الأكسدة تحت تأثير KMnO 4، K 2 Cr 2 O 7، HNO 3، إلخ.
لا يحدث أي تفاعل كيميائي (على غرار الألكانات).
خصائص متجانسات البنزين
في متجانسات البنزين، يتم التمييز بين النواة والسلسلة الجانبية (جذور الألكيل). الخصائص الكيميائية لجذور الألكيل تشبه الألكانات. ويتجلى تأثير حلقة البنزين عليها في حقيقة أن تفاعلات الاستبدال تتضمن دائمًا ذرات الهيدروجين في ذرة الكربون المرتبطة مباشرة بحلقة البنزين، وكذلك في الأكسدة الأسهل لروابط C-H.

يتجلى تأثير جذر الألكيل المتبرع بالإلكترون (على سبيل المثال، -CH 3) على حلقة البنزين في زيادة الشحنات السالبة الفعالة على ذرات الكربون في المواضع أورثو وبارا؛ ونتيجة لذلك، يتم تسهيل استبدال ذرات الهيدروجين المرتبطة بها. ولذلك، فإن متجانسات البنزين يمكن أن تشكل منتجات ثلاثية الاستبدال (والبنزين عادة ما يشكل مشتقات أحادية الاستبدال).
الخصائص الفيزيائية
البنزين وأقرب متجانساته عبارة عن سوائل عديمة اللون ذات رائحة معينة. الهيدروكربونات العطرية أخف من الماء ولا تذوب فيه، ولكنها قابلة للذوبان بسهولة في المذيبات العضوية - الكحول والأثير والأسيتون.
يعتبر البنزين ومماثلاته في حد ذاته مذيبات جيدة للعديد من المواد العضوية. تحترق جميع الساحات بلهب دخاني بسبب ارتفاع نسبة الكربون في جزيئاتها.
يتم عرض الخصائص الفيزيائية لبعض الساحات في الجدول.
طاولة. الخصائص الفيزيائية لبعض الساحات
|
اسم |
صيغة |
ر°.pl.، |
ر°.ب.ب.، |
|
البنزين |
C6H6 |
5,5 |
80,1 |
|
التولوين (ميثيل بنزين) |
ج 6 ح 5 الفصل 3 |
95,0 |
110,6 |
|
إيثيل بنزين |
ج6ح5ج2ح5 |
95,0 |
136,2 |
|
الزيلين (ثنائي ميثيل بنزين) |
ج6 ح4 (الفصل3)2 |
||
|
تقويمي- |
25,18 |
144,41 |
|
|
ميتا- |
47,87 |
139,10 |
|
|
زوج- |
13,26 |
138,35 |
|
|
بروبيل بنزين |
ج6ح5(الفصل2)2الفصل3 |
99,0 |
159,20 |
|
الكومين (أيزوبروبيل بنزين) |
ج 6 ح 5 تش(الفصل 3) 2 |
96,0 |
152,39 |
|
الستايرين (الفينيل بنزين) |
ج6 ح5 CH=CH2 |
30,6 |
145,2 |
البنزين – غليان منخفض ( ربالة= 80.1 درجة مئوية)، سائل عديم اللون، غير قابل للذوبان في الماء
انتباه! البنزين – السم، يؤثر على الكلى، يغير تركيبة الدم (مع التعرض لفترة طويلة)، يمكن أن يعطل بنية الكروموسومات.
معظم الهيدروكربونات العطرية مهددة للحياة وسامة.
تحضير الأرينات (البنزين ومماثلاته)
في المختبر
1. اندماج أملاح حمض البنزويك مع القلويات الصلبة
C6H5-COONa + هيدروكسيد الصوديوم ر →ج6 ح6 + نا2كو3
بنزوات الصوديوم
2. رد فعل Wurtz المناسب: (هنا G هو الهالوجين)
ج6ح 5 -ز + 2نا + ر-ز →ج 6 ح 5 - ر + 2 ناز
مع 6 ح 5 -Cl + 2Na + CH 3 -Cl → C 6 ح 5 -CH 3 + 2NaCl
في الصناعة
- معزولة عن النفط والفحم عن طريق التقطير التجزيئي والإصلاح؛
- من قطران الفحم وغاز فرن فحم الكوك
1. نزع هيدروكلوريد الألكاناتتحتوي على أكثر من 6 ذرات كربون:
C6H14 ر , كات→ج 6 ح 6 + 4 ح 2
2. تثليث الأسيتيلين(للبنزين فقط) - ص. زيلينسكي:
3س2 ح 2 600 درجةج، يمثل. الفحم→ج 6 ح 6
3. نزع الهيدروجينالهكسان الحلقي ومماثلاته:
أثبت الأكاديمي السوفييتي نيكولاي ديميترييفيتش زيلينسكي أن البنزين يتكون من الهكسان الحلقي (نزع الهيدروجين من الألكانات الحلقية)
C6H12 ر، كات→ج 6 ح 6 + 3 ح 2

C6H11-CH3 ر , كات→ج 6 ح 5 -CH 3 + 3 ح 2
ميثيل سيكلوهكسانتولوين
4. ألكلة البنزين(تحضير متجانسات البنزين) – ص فريدل الحرف.
ج6 ح6 + ج2 ح5 -Cl ر، AlCl3→C 6 ح 5 -C 2 ح 5 + حمض الهيدروكلوريك
كلوروإيثان إيثيل بنزين

الخواص الكيميائية للأرينات
أنا. تفاعلات الأكسدة
1. الاحتراق (لهب التدخين):
2C6H6 + 15O2 ر→12CO2 + 6H2O + Q
2. في الظروف العادية، لا يغير البنزين لون ماء البروم والمحلول المائي لبرمنجنات البوتاسيوم
3. تتأكسد متجانسات البنزين بواسطة برمنجنات البوتاسيوم (تغير لون برمنجنات البوتاسيوم):
أ) في بيئة حمضية لحمض البنزويك
عندما تتعرض متجانسات البنزين لبرمنجنات البوتاسيوم وغيرها من العوامل المؤكسدة القوية، تتأكسد السلاسل الجانبية. ومهما كانت سلسلة البديل معقدة، فإنها يتم تدميرها، باستثناء ذرة الكربون التي تتأكسد إلى مجموعة الكربوكسيل.
متجانسات البنزين ذات السلسلة الجانبية الواحدة تعطي حمض البنزويك:
المتجانسات التي تحتوي على سلسلتين جانبيتين تعطي أحماض ديباسيك:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
مبسط :
C6H5-CH3+3O KMnO4→C 6 H 5 COOH + H 2 O
ب) في أملاح حمض البنزويك المحايدة والقلوية قليلاً
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COOك + ك أوه + 2MnO 2 + H 2 O
ثانيا. تفاعلات الإضافة (أصعب من الألكينات)
1. الهلجنة
ج6 ح6 +3كل2 ح ν → C6H6Cl6 (سداسي كلورو حلقي الهكسان - سداسي كلوران)
2. الهدرجة
C6H6 + 3H2 ر , نقطةأوني→ ج 6 ح 12 (الهكسان الحلقي)
3. البلمرة
ثالثا. ردود الفعل الاستبدالية - آلية الأيونات (أخف من الألكانات)
ب) متجانسات البنزين عند التشعيع أو التسخين
الخصائص الكيميائية لجذور الألكيل تشبه الألكانات. يتم استبدال ذرات الهيدروجين الموجودة بها بالهالوجين بواسطة آلية جذرية حرة. ولذلك، في حالة عدم وجود محفز، عند التسخين أو الأشعة فوق البنفسجية، يحدث تفاعل استبدال جذري في السلسلة الجانبية. يؤدي تأثير حلقة البنزين على بدائل الألكيل إلى حقيقة ذلك يتم دائمًا استبدال ذرة الهيدروجين بذرة الكربون المرتبطة مباشرة بحلقة البنزين (ذرة الكربون).
1) ج6 ح5 -CH3 + Cl2 ح ν → C 6 H 5 -CH 2 -Cl + حمض الهيدروكلوريك
ج) متجانسات البنزين في وجود محفز
ج6 ح5 -CH3 + Cl2 AlCl 3 → (خليط أورتا، زوج من المشتقات) +حمض الهيدروكلوريك
2. النتروجين (مع حمض النيتريك)
ج6 ح6 + هو-نو 2 ر، H2SO4→C 6 H 5 -NO 2 + H 2 O
النيتروبنزين - يشم اللوز!
ج 6 ح 5 -CH 3 + 3H O-NO 2 ر، H2SO4→ مع ح 3 - ج 6 ح 2 (رقم 2) 3 + 3 ح 2 س2,4,6-ثلاثي نيترو تولوين (تول، تي إن تي)
تطبيق البنزين ومماثلاته
البنزين C6H6 مذيب جيد. يعمل البنزين كمادة مضافة على تحسين جودة وقود السيارات. إنه بمثابة مادة خام لإنتاج العديد من المركبات العضوية العطرية - النيتروبنزين C 6 H 5 NO 2 (المذيب الذي يتم الحصول على الأنيلين منه)، كلورو البنزين C 6 H 5 Cl، الفينول C 6 H 5 OH، الستايرين، إلخ.
التولوين C6H5 –CH3 – مذيب يستخدم في إنتاج الأصباغ الطبية والمتفجرات (TNT (TNT)، أو 2,4,6-ثلاثي نيتروتولوين TNT).
الزيلين C6H4(CH3)2. الزيلين التقني عبارة عن خليط من ثلاثة أيزومرات ( أورثو-, ميتا- و زوج- الزيلين) – يستخدم كمذيب ومنتج أولي لتخليق العديد من المركبات العضوية.
الأيزوبروبيل بنزينيستخدم C 6 H 5 –CH (CH 3) 2 لإنتاج الفينول والأسيتون.
مشتقات البنزين المكلورةتستخدم لحماية النباتات. وبالتالي، فإن منتج استبدال ذرات H في البنزين بذرات الكلور هو سداسي كلور البنزين C 6 Cl 6 - مبيد للفطريات؛ يتم استخدامه للمعالجة الجافة لبذور القمح والجاودار ضد التفحم. منتج إضافة الكلور إلى البنزين هو سداسي كلور حلقي الهكسان (سداسي كلور) C 6 H 6 Cl 6 - مبيد حشري. يتم استخدامه لمكافحة الحشرات الضارة. المواد المذكورة تنتمي إلى المبيدات الحشرية - الوسائل الكيميائية لمكافحة الكائنات الحية الدقيقة والنباتات والحيوانات.
الستايرينيتبلمر C 6 H 5 – CH = CH 2 بسهولة شديدة، مكونًا البوليسترين، وعند البلمرة المشتركة مع البيوتادين، مطاط ستايرين بوتادين.
تجارب الفيديو
أرين أو عطريةالهيدروكربونات (البنزينويد) هي مركبات تحتوي جزيئاتها على مجموعات دورية مستقرة من الذرات (حلقات البنزين) مع نظام مغلق من الروابط المترافقة.
يتم تفسير الطابع العطري للأرين من خلال التركيب الإلكتروني لحلقة البنزين.
معايير العطرية. بناءً على دراسة الأنظمة المترافقة الحلقية، فقد ثبت أن المركب يكون عطريًا إذا خضع حكم هوكل: زيادة الاستقرار الديناميكي الحراري (العطرية) لا تمتلكها إلا الأنظمة المترافقة أحادية الحلقة (البوليينات) التي لها بنية مستوية وتحتوي على 4n + 2 إلكترونات في سلسلة اقتران مغلقة (حيث n عدد صحيح: 0، 1، 2، 3، الخ). د). الحلقات التي تحتوي على 4n إلكترونات تكون مضادة للرائحة (غير مستقرة).
ظروف العطريةيتطابق جزيء البنزين C 6 H 6 تمامًا، في نظام الاقتران الذي يشتمل على 6 إلكترونات - سداسية عطرية (وفقًا للصيغة 4n + 2 مع n = 1). الحلقات العطرية أكثر استقرارًا بكثير من نظائرها اللاحلقية المترافقة مع نفس العدد من الإلكترونات، أي. البنزين أكثر استقرارًا من CH 2 =CH –CH = CH –CH = CH 2 (هكساترين-1،3،5).
التسميات. وتستخدم على نطاق واسع أسماء تافهة (التولوين، الزيلين، الكومين، وما إلى ذلك). يتم إنشاء الأسماء النظامية لمتجانسات البنزين من اسم الجذر الهيدروكربوني (البادئة) وكلمة البنزين (الجذر): C 6 H 5 - CH 3 - ميثيل بنزين (تولوين)، C 6 H 5 - C 2 H 5 - إيثيل بنزين، C 6 H 5 - CH (CH 3) 2 - إيزوبروبيل بنزين (الكيومين). إذا كان هناك جذرين أو أكثر، يتم تحديد موقعهم من خلال عدد ذرات الكربون في الحلقة التي يرتبطون بها. يتم ترقيم الحلقة بحيث يكون عدد الجذور هو الأصغر.
بالنسبة للبنزين غير المستبدل RC 6 H 4 R، يتم أيضًا استخدام طريقة أخرى لبناء الأسماء، حيث تتم الإشارة إلى موضع البدائل قبل الاسم التافه للمركب مع البادئات: بدائل ortho-(o-) على الكربون المجاور ذرات الحلقة، أي. في الموضع 1,2-; بدائل meta- (m-) من خلال ذرة كربون واحدة (1،3-)؛ بدائل الفقرة (ع-) على الجانبين المتقابلين (1،4-).
الايزومرية. في سلسلة متجانسات البنزين، تظهر الأيزومرية الهيكلية: 1) مواضع بدائل البنزين ثنائي وثلاثي ورباعي الاستبدال (على سبيل المثال، o- وm- وp-xylenes)؛ 2) هيكل عظمي من الكربون في سلسلة جانبية تحتوي على 3 ذرات كربون على الأقل (C 6 H 5 -CH 2 CH 2 CH 3 - n-propylbenzene وC 6 H 5 -CH(CH 3) 2 - إيزوبروبيل بنزين أو كومين)؛ 3) إيزومرية البدائل R، بدءًا من R = C 2 H 5 (على سبيل المثال، الصيغة الجزيئية C 8 H 10 تتوافق مع 4 أيزومرات: o-، m-، p-xylenes CH 3 C 6 H 4 CH 3) وإيثيل بنزين C 6 H 5 C 2 H 5)؛ 4) الأيزومرية بين الطبقات مع المركبات غير المشبعة (على سبيل المثال، الصيغة C 6 H 6 باستثناء البنزين
تحتوي على مركبات CH 2 = CH –C≡C –CH = CH2، CH≡C –CH = CH –CH = CH2، وما إلى ذلك، بالإضافة إلى دورات غير مشبعة). لا توجد أيزومرية مكانية بالنسبة لحلقة البنزين في الأرينات المستبدلة.
قاعدة هوكل:
الجزيئات التي تخضع لقاعدة هوكل هي عطرية: النظام المترافق أحادي الحلقة المستوي الذي يحتوي على (4n + 2)π إلكترونات (حيث n = 0,1,2...) هو عطري.
آلية الاستبدال الكهربي:
1المرحلة 1: تشكيل المركب p.في هذه الحالة، يتم تشكيل رابطة ضعيفة بين سحابة الإلكترون p لحلقة البنزين والكاشف الإلكتروفيلي مع نقص كثافة الإلكترون مع الحفاظ على السداسية العطرية. عادة ما يقع الكاشف الكهربي بشكل عمودي على مستوى الحلقة على طول محور التماثل. تحدث هذه المرحلة بسرعة ولا تؤثر على معدل التفاعل. تم إثبات وجود المركب p بواسطة التحليل الطيفي للأشعة فوق البنفسجية...
المرحلة 2: تشكيل ب المركب. هذه المرحلة بطيئة ولا رجعة فيها عمليا. تتشكل رابطة تساهمية b بين محب الإلكتروفيل وذرة الكربون في حلقة البنزين، وتنتقل ذرة الكربون من حالة التكافؤ spI إلى حالة التكافؤ spI مع اختلال السداسية العطرية وتكوين كاتيون سيكلوهيكسادينيل (أيون البنزين). يشكل كاتيون البنزين مع الأيون المضاد مركبًا أيونيًا يوصل التيار الكهربائي جيدًا. في أيون البنزين، توجد جميع ذرات الكربون في نفس المستوى، وتكون بدائل ذرة الكربون المهجنة YSP متعامدة معها.
المرحلتان الثالثة والرابعة: تكوين المركب الثاني والأرومة.يمكن تحويل المركب b إلى مركب p جديد ومستقر قليلاً، والذي يتم نزع بروتوناته تحت تأثير قاعدة، عادة ما تكون أيون مضاد.
البنزين كممثل للأرين. هيكل جزيء البنزين. اقتران باي بوند. الايزومرية وتسميات arenes. متجانسات البنزين. تحضير الأرينات وخصائصها الفيزيائية
رينيس (الهيدروكربونات العطرية)
- الأرينات أو الهيدروكربونات العطرية عبارة عن مركبات تحتوي جزيئاتها على مجموعات دورية مستقرة من الذرات (نوى البنزين) مع نظام مغلق من الروابط المترافقة.
أبسط الممثلين (الساحات أحادية النواة):
الساحات متعددة النواة: النفثالين ج10 ح8أنثراسين ج14ن10إلخ.نشأ مصطلح "المركبات العطرية" منذ زمن طويل بسبب حقيقة أن بعض ممثلي هذه السلسلة من المواد لديهم رائحة طيبة. ومع ذلك، في الوقت الحاضر، أصبح لمفهوم "العطرية" معنى مختلف تمامًا.الرائحة العطرية للجزيء تعني زيادة استقراره، بسبب عدم تمركز إلكترونات π في النظام الدوري.معايير العطرية آرين:
- تشكل ذرات الكربون في الحالة الهجينة sp2 نظامًا دوريًا.
- توجد ذرات الكربون في نفس المستوى (الدورة لها بنية مسطحة).
- نظام مغلق من الوصلات المترافقة يحتوي على
- 4ن+2إلكترونات π ( ن- عدد صحيح).
يلبي جزيء البنزين هذه المعايير بالكامل. ج6ح6.
1. هيكل البنزين
البنزين ج6ح6– سلف الهيدروكربونات العطرية.
تكون كل من ذرات الكربون الست الموجودة في جزيئها في حالة تهجين sp2 وترتبط بذرتي كربون مجاورتين وذرة هيدروجين بواسطة ثلاث روابط σ. زوايا الرابطة بين كل زوج من روابط π هي 120 درجة. وبالتالي، فإن الهيكل العظمي للروابط σ هو شكل سداسي منتظم حيث تقع جميع ذرات الكربون وجميع روابط σ C-C وC-H في نفس المستوى:
تتفاعل إلكترونات p لجميع ذرات الكربون مع بعضها البعض من خلال التداخل الجانبي لـ 2p-AOs المجاورة المتعامدة مع مستوى الهيكل العظمي لحلقة البنزين. وهي تشكل سحابة إلكترون دائرية واحدة مركزة أعلى وأسفل مستوى الحلقة.
جميع روابط C-C في البنزين متكافئة، طولها 0.140 نانومتر، وهو ما يتوافق مع قيمة وسيطة بين طول الرابطة الفردية (0.154 نانومتر) والرابطة المزدوجة (0.134 نانومتر). وهذا يعني أنه في جزيء البنزين لا توجد روابط بسيطة ومزدوجة بحتة بين ذرات الكربون (كما في الصيغة التي اقترحها الكيميائي الألماني ف. كيكولي عام 1865)، وجميعها متوازية (غير متمركزة، انظر الرسوم المتحركة). لذلك، تم تصوير الصيغة الهيكلية للبنزين على شكل مسدس منتظم (هيكل عظمي σ) ودائرة بداخله، مما يشير إلى روابط π غير متمركزة:
غالبًا ما يتم استخدام صيغة Kekule أيضًا، ولكن يؤخذ في الاعتبار أنها تنقل بنية الجزيء بشكل مشروط فقط.
2. متجانسات البنزين. التسميات والايزومرية
متجانسات البنزين هي مركبات تتشكل عن طريق استبدال ذرة هيدروجين واحدة أو أكثر في جزيء البنزين بجذور الهيدروكربون (R):
الصيغة العامة لسلسلة البنزين المتماثلةCnH2n-6(ن ≥ 6).
التسميات. وتستخدم على نطاق واسع أسماء تافهة (التولوين، الزيلين، الكومين، وما إلى ذلك). يتم بناء الأسماء المنهجية من اسم الجذر الهيدروكربوني (البادئة) والكلمة البنزين(جذر):
ج6ح5-CH3 ج 6 ح 5 - ج 2 ح 5 ج 6 ح 5 - ج 3 ح 7
ميثيل بنزين (التولوين) إيثيل بنزين بروبيل بنزين
إذا كان هناك جذرين أو أكثر، يتم تحديد موقعهم من خلال عدد ذرات الكربون في الحلقة التي يرتبطون بها. يتم ترقيم الحلقة بحيث يكون عدد الجذور هو الأصغر. على سبيل المثال:
للبنزين غير المستبدل أ-ج 6 ح 4-ريتم أيضًا استخدام طريقة أخرى لبناء الأسماء، حيث تتم الإشارة إلى موضع البدائل قبل الاسم التافه للمركب مع البادئات:
أورثو- (يا-) بدائل على ذرات الكربون المجاورة للحلقة، أي. 1,2-;
ميتا- (م-) البدائل من خلال ذرة كربون واحدة (1،3-)؛
زوج- (ن-) البدائل على الجانبين المتقابلين للحلقة (1،4-).
الجذور العطرية أحادية التكافؤ لها الاسم العام " أريل". ومن بين هذه العناصر، هناك اثنان هما الأكثر شيوعًا في تسميات المركبات العضوية: C6H5- (فينيل) و C6H5CH2- (البنزيل).
الايزومرية(الهيكلية):
1) مناصب النوابل دي-, ثلاثة- و تترا- البنزين المستبدل (على سبيل المثال، يا-, م- و ن-زيلين)؛
2) هيكل عظمي من الكربون في السلسلة الجانبيةتحتوي على 3 ذرات كربون على الأقل:
3) ايزومرية البدائل R، بدءًا من R - C 2 H 5.
على سبيل المثال، الصيغة الجزيئية ج8 ح10 4 ايزومرات تتوافق:
ثلاثة زيلين CH 3 -C 6 ح 4 -CH 3 (س-، م-، ص-) وإيثيل بنزين C6H5-C2H5.
لا توجد أيزومرية مكانية بالنسبة إلى حلقة البنزين في ألكيل بنزين.
تحضير الهيدروكربونات العطرية
المصادر الطبيعية الرئيسية للهيدروكربونات العطرية هي الفحم والنفط.
تشير التفاعلات لإنتاج الأرينات إلى العلاقة بين المجموعات المختلفة من الهيدروكربونات وإمكانية تحولها إلى بعضها البعض.