"Benzin halqası" anlayışı dərhal deşifrə tələb edir. Bunun üçün ən azı benzol molekulunun quruluşunu qısaca nəzərdən keçirmək lazımdır. Benzolun ilk quruluşu 1865-ci ildə alman alimi A.Kekule tərəfindən təklif edilmişdir:
Ən mühüm aromatik karbohidrogenlərə benzol C 6 H 6 və onun homoloqları daxildir: toluol C 6 H 5 CH 3, ksilen C 6 H 4 (CH 3) 2 və s.; naftalin C 10 H 8, antrasen C 14 H 10 və onların törəmələri.
Benzol molekulundakı karbon atomları müntəzəm düz altıbucaqlı əmələ gətirir, baxmayaraq ki, o, adətən uzunsov şəkildə çəkilir.
Benzol molekulunun strukturu, nəhayət, onun asetilendən əmələ gəlməsi reaksiyası ilə təsdiqləndi. Struktur formul üç tək və üç cüt alternativ karbon-karbon bağını təsvir edir. Ancaq belə bir görüntü molekulun əsl quruluşunu çatdırmır. Əslində, benzoldakı karbon-karbon bağları ekvivalentdir və tək və ya ikiqat bağlardan fərqli xüsusiyyətlərə malikdir. Bu xüsusiyyətlər benzol molekulunun elektron quruluşu ilə izah olunur.
Benzolun elektron quruluşu
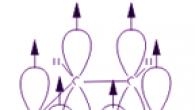
Benzol molekulunda hər bir karbon atomu sp 2 hibridləşmə vəziyyətindədir. İki qonşu karbon atomu və bir hidrogen atomu ilə üç σ bağı ilə bağlıdır. Nəticə düz altıbucaqlıdır: bütün altı karbon atomu və bütün σ bağları C-C və C-H eyni müstəvidə yerləşir. Hibridləşmədə iştirak etməyən dördüncü elektronun (p-elektron) elektron buludu dumbbell formasına malikdir və benzol halqasının müstəvisinə perpendikulyar yönümlüdür. Qonşu karbon atomlarının belə p-elektron buludları halqanın müstəvisinin üstündə və altında üst-üstə düşür.

Nəticədə, altı p-elektron ümumi elektron buludu və bütün karbon atomları üçün vahid kimyəvi bağ əmələ gətirir. Böyük elektron müstəvisinin iki bölgəsi σ bağ müstəvisinin hər iki tərəfində yerləşir.

p-elektron buludu karbon atomları arasındakı məsafənin azalmasına səbəb olur. Benzol molekulunda onlar eynidir və 0,14 nm-ə bərabərdir. Tək və ikiqat əlaqə vəziyyətində bu məsafələr müvafiq olaraq 0,154 və 0,134 nm olacaqdır. Bu o deməkdir ki, benzol molekulunda tək və ya ikiqat rabitə yoxdur. Benzol molekulu eyni müstəvidə yerləşən eyni CH qruplarının sabit altı üzvlü dövrüdür. Benzoldakı karbon atomları arasındakı bütün bağlar ekvivalentdir, bu da benzol halqasının xarakterik xüsusiyyətlərini müəyyən edir. Bu, içərisində dairəsi (I) olan müntəzəm altıbucaqlı şəklində benzolun struktur formulunda ən dəqiq şəkildə əks olunur. (Dairə karbon atomları arasındakı bağların ekvivalentliyini simvollaşdırır.) Bununla belə, Kekulenin qoşa bağları (II) göstərən düsturundan da tez-tez istifadə olunur:

Benzol halqası adətən aromatiklik adlanan müəyyən xüsusiyyətlərə malikdir.
Homoloji sıra, izomeriya, nomenklatura
Şərti olaraq arenaları iki sıraya bölmək olar. Birincisinə benzol törəmələri (məsələn, toluol və ya bifenil), ikincisinə kondensasiya olunmuş (polinüvəli) arenlər daxildir (onlardan ən sadəi naftalindir):

Benzolun homoloji seriyası C n H 2 n -6 ümumi formuluna malikdir. Homoloqlar bir və ya bir neçə hidrogen atomunun müxtəlif karbohidrogen radikalları ilə əvəz olunduğu benzol törəmələri hesab edilə bilər. Məsələn, C 6 H 5 -CH 3 - metilbenzol və ya toluol, C 6 H 4 (CH 3) 2 - dimetilbenzol və ya ksilen, C 6 H 5 -C 2 H 5 - etilbenzol və s.

Benzoldakı bütün karbon atomları ekvivalent olduğundan onun ilk homoloqu olan toluolun izomerləri yoxdur. İkinci homoloq, dimetilbenzol, metil qruplarının (əvəzedicilərin) nisbi düzülüşü ilə fərqlənən üç izomerə malikdir. Bu, əvəzedicilərin qonşu karbon atomlarında yerləşdiyi orto- (qısaldılmış o-) və ya 1,2-izomerdir. Əvəzedicilər bir karbon atomu ilə ayrılırsa, bu, meta- (qısaldılmış m-) və ya 1,3-izomerdir və iki karbon atomu ilə ayrılırsa, para- (qısaldılmış p-) və ya 1,4-izomer. Adlarda əvəzedicilər hərflərlə (o-, m-, p-) və ya rəqəmlərlə təyin olunur.

Fiziki xassələri
Benzolun homoloji seriyasının ilk üzvləri xüsusi qoxusu olan rəngsiz mayelərdir. Onların sıxlığı 1-dən azdır (sudan yüngül). Suda həll olunmur. Benzol və onun homoloqları bir çox üzvi maddələr üçün yaxşı həlledicilərdir. Arenalar molekullarında yüksək karbon tərkibinə görə dumanlı alovla yanır.
Kimyəvi xassələri
Aromatiklik benzolun və onun homoloqlarının kimyəvi xassələrini müəyyən edir. Altı elektronlu π sistemi adi iki elektronlu π bağlarından daha sabitdir. Buna görə də aromatik karbohidrogenlər üçün əlavə reaksiyalar doymamış karbohidrogenlərə nisbətən daha az olur. Arenlər üçün ən xarakterik reaksiyalar əvəzetmə reaksiyalarıdır. Beləliklə, aromatik karbohidrogenlər kimyəvi xassələrinə görə doymuş və doymamış karbohidrogenlər arasında aralıq mövqe tuturlar.
I. Əvəzetmə reaksiyaları
1. Halogenləşmə (Cl 2, Br 2 ilə)

2. Nitrasiya

3. Sulfonasiya

4. Alkilləşmə (benzol homoloqları əmələ gəlir) - Friedel-Krafts reaksiyaları

Benzolun alkilləşməsi alkenlərlə reaksiya verdikdə də baş verir:

Stirol (vinilbenzol) etilbenzolun dehidrogenləşdirilməsi ilə alınır:

II. Əlavə reaksiyalar
1. Hidrogenləşmə

2. Xlorlama

III. Oksidləşmə reaksiyaları
1. Yanma
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. KMnO 4, K 2 Cr 2 O 7, HNO 3 və s. təsiri altında oksidləşmə.
Heç bir kimyəvi reaksiya baş vermir (alkanlara bənzər).
Benzol homoloqlarının xassələri
Benzol homoloqlarında nüvə və yan zəncir (alkil radikalları) fərqlənir. Alkil radikallarının kimyəvi xassələri alkanlara bənzəyir; benzol halqasının onlara təsiri onda özünü göstərir ki, əvəzetmə reaksiyaları həmişə benzol halqası ilə birbaşa bağlı olan karbon atomunda hidrogen atomlarını əhatə edir, həmçinin C-H bağlarının daha asan oksidləşməsindədir.

Elektron verən alkil radikalının (məsələn, -CH 3) benzol halqasına təsiri orto və para mövqelərində karbon atomlarına təsirli mənfi yüklərin artması ilə özünü göstərir; nəticədə əlaqəli hidrogen atomlarının dəyişdirilməsi asanlaşdırılır. Buna görə də, benzolun homoloqları üçəvəzlənmiş məhsullar əmələ gətirə bilər (və benzol adətən monoəvəz edilmiş törəmələr əmələ gətirir).
Fiziki xassələri
Benzol və onun ən yaxın homoloqları xüsusi qoxuya malik rəngsiz mayelərdir. Aromatik karbohidrogenlər sudan yüngüldür və onda həll olunmur, lakin üzvi həlledicilərdə - spirtdə, efirdə, asetonda asanlıqla həll olunur.
Benzol və onun homoloqları bir çox üzvi maddələr üçün yaxşı həlledicilərdir. Bütün arenalar molekullarında yüksək karbon tərkibinə görə dumanlı alovla yanır.
Bəzi arenaların fiziki xüsusiyyətləri cədvəldə təqdim olunur.
Cədvəl. Bəzi arenaların fiziki xassələri
|
ad |
Formula |
t°.pl., |
t°.b.p., |
|
Benzol |
C6H6 |
5,5 |
80,1 |
|
Toluol (metilbenzol) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
Etilbenzol |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Ksilen (dimetilbenzol) |
C 6 H 4 (CH 3) 2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
qoşa- |
13,26 |
138,35 |
|
|
Propilbenzol |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Kumen (izopropilbenzol) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
Stirol (vinilbenzol) |
C 6 H 5 CH=CH 2 |
30,6 |
145,2 |
Benzol - aşağı qaynama ( tbalya= 80,1°C), rəngsiz maye, suda həll olunmur
Diqqət! Benzol – zəhər, böyrəklərə təsir edir, qan formulunu dəyişir (uzun müddət məruz qalma ilə), xromosomların strukturunu poza bilər.
Aromatik karbohidrogenlərin əksəriyyəti həyat üçün təhlükəli və zəhərlidir.
Arenlərin hazırlanması (benzol və onun homoloqları)
Laboratoriyada
1. Benzoy turşusu duzlarının bərk qələvilərlə birləşməsi
C6H5-COONa + NaOH t → C 6 H 6 + Na 2 CO 3
natrium benzoat
2. Wurtz-Fitting reaksiyası: (burada G halogendir)
C 6H 5 -G + 2Na + R-G →C 6 H 5 - R + 2 NaG
İLƏ 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
Sənayedə
- fraksiya distillə və reforminq yolu ilə neft və kömürdən təcrid olunur;
- kömür qatranından və koks qazından
1. Alkanların dehidrosiklləşməsi 6-dan çox karbon atomu ilə:
C6H14 t , kat→C 6 H 6 + 4H 2
2. Asetilenin trimerləşməsi(yalnız benzol üçün) - r. Zelinski:
3С 2 H 2 600°C, hərəkət. kömür→C 6 H 6
3. Dehidrogenləşmə sikloheksan və onun homoloqları:
Sovet akademiki Nikolay Dmitriyeviç Zelinski müəyyən etdi ki, benzol sikloheksandan (sikloalkanların dehidrogenləşməsi) əmələ gəlir.
C6H12 t, kat→C 6 H 6 + 3H 2

C6H11-CH3 t , kat→C 6 H 5 -CH 3 + 3H 2
metilsikloheksantoluol
4. Benzolun alkilləşməsi(benzol homoloqlarının hazırlanması) – r Friedel-Crafts.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→C 6 H 5 -C 2 H 5 + HCl
xloroetan etilbenzol

Arenlərin kimyəvi xassələri
I. Oksidləşmə REAKSİYASI
1. Yanma (tüstülənən alov):
2C6H6 + 15O2 t→12CO 2 + 6H 2 O + Q
2. Normal şəraitdə benzol bromlu suyun və kalium permanqanatın sulu məhlulunun rəngini dəyişmir.
3. Benzol homoloqları kalium permanqanatla oksidləşir (kalium permanqanatın rəngini dəyişir):
A) turş mühitdə benzoy turşusuna
Benzol homoloqları kalium permanqanat və digər güclü oksidləşdirici maddələrə məruz qaldıqda yan zəncirlər oksidləşir. Əvəzedicinin zənciri nə qədər mürəkkəb olsa da, karboksil qrupuna oksidləşən a-karbon atomu istisna olmaqla, o, məhv olur.
Bir yan zəncirli benzolun homoloqları benzoy turşusu verir:
İki yan zəncirdən ibarət homoloqlar iki əsaslı turşuları verir:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Sadələşdirilmiş :
C6H5-CH3+3O KMnO4→C 6 H 5 COOH + H 2 O
B) neytral və az qələvi-benzoy turşusu duzlarında
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. ƏLAVƏ REAKSİYASI (alkenlərdən daha sərt)
1. Halogenləşmə
C 6 H 6 +3Cl 2 h ν → C6H6Cl6 (heksaxlorosikloheksan - heksaxloran)
2. Hidrogenləşmə
C6H6 + 3H2 t , Ptvə yaNi→C 6 H 12 (sikloheksan)
3. Polimerləşmə
III. ƏVƏZİNƏ REAKSİYALARI - ion mexanizmi (alkanlardan daha yüngül)
b) şüalanma və ya qızdırma zamanı benzol homoloqları
Alkil radikallarının kimyəvi xassələri alkanlara bənzəyir. Onlardakı hidrogen atomları sərbəst radikal mexanizmlə halogenlə əvəz olunur. Buna görə katalizator olmadıqda, istilik və ya UV şüalanması zamanı yan zəncirdə radikal əvəzetmə reaksiyası baş verir. Benzol halqasının alkil əvəzedicilərinə təsiri ona gətirib çıxarır ki Hidrogen atomu həmişə benzol halqasına (a-karbon atomu) birbaşa bağlı olan karbon atomunda əvəz olunur.
1) C 6 H 5 -CH 3 + Cl 2 h ν → C 6 H 5 -CH 2 -Cl + HCl
c) katalizatorun iştirakı ilə benzol homoloqları
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (orta qarışığı, törəmə cütü) +HCl
2. Nitrasiya (azot turşusu ilə)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
nitrobenzol - qoxu badam!
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ İLƏ H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-trinitrotoluen (tol, TNT)
Benzol və onun homoloqlarının tətbiqi
Benzol C 6 H 6 yaxşı həlledicidir. Bir əlavə olaraq benzol motor yanacağının keyfiyyətini yaxşılaşdırır. Bir çox aromatik üzvi birləşmələrin - nitrobenzol C 6 H 5 NO 2 (anilinin alındığı həlledici), xlorbenzol C 6 H 5 Cl, fenol C 6 H 5 OH, stirol və s. istehsalı üçün xammal kimi xidmət edir.
Toluol C 6 H 5 –CH 3 – boyalar, dərman və partlayıcı maddələrin istehsalında istifadə olunan həlledici (TNT (TNT) və ya 2,4,6-trinitrotoluen TNT).
Ksilenlər C6H4(CH3)2. Texniki ksilen üç izomerin qarışığıdır ( orto-, meta- Və cüt-ksilenlər) – bir çox üzvi birləşmələrin sintezi üçün həlledici və başlanğıc məhsul kimi istifadə olunur.
İzopropilbenzol C 6 H 5 –CH (CH 3) 2 fenol və aseton istehsal etmək üçün istifadə olunur.
Benzolun xlorlu törəmələri bitki mühafizəsi üçün istifadə olunur. Beləliklə, benzolda H atomlarının xlor atomları ilə əvəz edilməsinin məhsulu heksaxlorbenzol C 6 Cl 6 - funqisiddir; buğda və çovdar toxumlarının iylənməyə qarşı quru müalicəsi üçün istifadə olunur. Xlorun benzolun əlavə edilməsinin məhsulu heksaxlorosikloheksan (heksaxloran) C 6 H 6 Cl 6 - insektisiddir; zərərli həşəratlara qarşı mübarizə aparmaq üçün istifadə olunur. Qeyd olunan maddələr pestisidlərə - mikroorqanizmlərə, bitkilərə və heyvanlara qarşı kimyəvi mübarizə vasitələrinə aiddir.
Stirol C 6 H 5 – CH = CH 2 çox asanlıqla polimerləşir, polistirol əmələ gətirir və butadien, stirol-butadien kauçukları ilə sopolimerləşdikdə.
VİDEO TƏCRÜBƏLƏR
Arenes və ya aromatik(benzenoid) karbohidrogenlər, molekullarında birləşmiş bağların qapalı sistemi ilə sabit siklik atom qrupları (benzol halqaları) olan birləşmələrdir.
Arenlərin aromatik xarakteri benzol halqasının elektron quruluşu ilə izah olunur.
Aromatiklik meyarları. Tsiklik konyuqasiyalı sistemlərin tədqiqi əsasında müəyyən edilmişdir ki, birləşmə aşağıdakılara tabe olduqda aromatikdir. Hükel qaydası: Artan termodinamik sabitliyə (aromatikliyə) yalnız planar quruluşa malik olan və qapalı konyuqasiya zəncirində 4n + 2 -elektron ehtiva edən monosiklik birləşmiş sistemlər (polienlər) malikdir (burada n tam ədəddir: 0, 1, 2, 3, s. d). Tərkibində 4n -elektron olan halqalar antiaromatikdir (sabitləşmiş).
Aromatiklik şərtləri Benzol molekulu C 6 H 6 tam uyğundur, birləşmə sistemində 6 -elektron iştirak edir - aromatik bir sekset (n = 1 ilə 4n + 2 düsturuna görə). Aromatik üzüklər eyni sayda π-elektronlu konjuge asiklik analoqlarından daha sabitdir, yəni. benzol CH 2 =CH–CH=CH–CH=CH2-dən (heksatrien-1,3,5) daha sabitdir.
Nomenklatura. Trivial adlar geniş istifadə olunur (toluol, ksilen, kumen və s.). Benzol homoloqlarının sistematik adları karbohidrogen radikalının adından (prefiks) və benzol (kök) sözündən qurulur: C 6 H 5 - CH 3 - metilbenzol (toluol), C 6 H 5 - C 2 H 5 - etilbenzol, C 6 H 5 - CH (CH 3) 2 – izopropilbenzol (kumen). İki və ya daha çox radikal varsa, onların mövqeyi bağlı olduqları halqadakı karbon atomlarının nömrələri ilə göstərilir. Halqanın nömrələnməsi radikalların sayının ən kiçik olması üçün aparılır.
Dəyişməmiş benzollar üçün RC 6 H 4 R adlarının qurulması üçün başqa üsuldan da istifadə olunur, burada əvəzedicilərin mövqeyi prefiksli birləşmənin mənasız adından əvvəl göstərilir: qonşu karbonda orto-(o-) əvəzedicilər. halqanın atomları, yəni. 1,2- mövqeyində; bir karbon atomu vasitəsilə meta- (m-) əvəzedicilər (1,3-); qarşı tərəflərdə para- (p-) əvəzedicilər (1,4-).
İzomerizm. Benzol homoloqları silsiləsində struktur izomerizmi meydana çıxır: 1) di-, tri- və tetra-əvəz edilmiş benzollar (məsələn, o-, m- və p-ksilenlər) üçün əvəzedicilərin mövqeləri; 2) ən azı 3 karbon atomu olan yan zəncirdə karbon skeleti (C 6 H 5 -CH 2 CH 2 CH 3 - n-propilbenzol və C 6 H 5 -CH(CH 3) 2 - izopropilbenzol və ya kumen); 3) R = C 2 H 5 ilə başlayan R əvəzedicilərinin izomeriyası (məsələn, C 8 H 10 molekulyar formulası 4 izomerə uyğundur: o-, m-, p-ksilenlər CH 3 C 6 H 4 CH 3 və etilbenzol C 6 H 5 C 2 H 5); 4) doymamış birləşmələrlə siniflərarası izomerizm (məsələn, benzol istisna olmaqla, C 6 H 6 düsturu
CH 2 =CH–C≡C–CH=CH2, CH≡C–CH=CH–CH=CH2 və s. birləşmələrə, həmçinin doymamış dövrlərə malikdir). Əvəz edilmiş arenlərdə benzol halqasına nisbətən məkan izomeriyası yoxdur.
Hükel qaydası:
Hückel qaydasına tabe olan molekullar aromatikdir: tərkibində (4n + 2)π-elektronları (burada n = 0,1,2...) olan planar monosiklik birləşmiş sistem aromatikdir.
Elektrofil əvəzetmə mexanizmi:
1Mərhələ 1: p-kompleksinin formalaşması. Bu zaman aromatik sexteti saxlayaraq, benzol halqasının p-elektron buludu ilə elektron sıxlığı çatışmazlığı olan elektrofil reagent arasında zəif bir əlaqə yaranır. Elektrofilik reagent adətən simmetriya oxu boyunca halqanın müstəvisinə perpendikulyar yerləşdirilir. Bu mərhələ tez baş verir və reaksiya sürətinə təsir etmir. p-kompleksinin mövcudluğu UV spektroskopiyası ilə sübut edilir...
Mərhələ 2: b-kompleksinin formalaşması. Bu mərhələ yavaş və praktiki olaraq geri dönməzdir. Benzol halqasının elektrofili ilə karbon atomu arasında kovalent b-bağ əmələ gəlir və aromatik sextetin pozulması və sikloheksadienil kationunun (benzenium ionunun) əmələ gəlməsi ilə karbon atomu spI-dən spI-valent vəziyyətə keçir. Benzol kationu əks ion ilə birlikdə elektrik cərəyanını yaxşı keçirən ion birləşməsini əmələ gətirir. Benzol ionunda bütün karbon atomları eyni müstəvidə yerləşir və ysp-hibridləşdirilmiş karbon atomunun əvəzediciləri ona perpendikulyardır.
3-cü və 4-cü mərhələlər: ikinci p-kompleksinin formalaşması və aromatizasiya. b-kompleksi yeni, bir qədər sabit p-kompleksinə çevrilə bilər, bazanın, adətən əks-ionun təsiri altında deprotonasiya olunur.
Arenlərin nümayəndəsi kimi benzol. Benzol molekulunun quruluşu. Pi-bağ konjuqasiyası. Arenlərin izomeriyası və nomenklaturası. Benzol homoloqları. Arenlərin hazırlanması, onların fiziki xassələri
A RENES (aromatik karbohidrogenlər)
- Arenlər və ya aromatik karbohidrogenlər, molekullarında birləşmiş bağların qapalı sistemi ilə sabit siklik atom qrupları (benzol nüvələri) olan birləşmələrdir.
Ən sadə nümayəndələr (tək nüvəli arenalar):
Çox nüvəli arenalar: naftalin C 10 H 8, antrasen C 14 N 10 və s."Aromatik birləşmələr" termini bu seriyanın bəzi nümayəndələrinin xoş qoxuya malik olması səbəbindən çoxdan yaranmışdır. Ancaq bu gün "aromatiklik" anlayışı tamamilə fərqli bir məna daşıyır.Molekulun aromatikliyi dedikdə, siklik sistemdə π-elektronların delokalizasiyası hesabına onun artan sabitliyi nəzərdə tutulur.Arene aromatiklik meyarları:
- sp 2 hibridləşmiş vəziyyətdə olan karbon atomları siklik sistem əmələ gətirir.
- Karbon atomları eyni müstəvidə yerləşir (dövrü düz bir quruluşa malikdir).
- Konjugat əlaqələrin qapalı sistemi ehtiva edir
- 4n+2π elektronlar ( n- tam).
Benzol molekulu bu meyarlara tam cavab verir. C 6 H 6.
1. Benzolun quruluşu
Benzol C 6 H 6– aromatik karbohidrogenlərin əcdadı.
Molekulunda olan altı karbon atomunun hər biri sp 2 hibridləşmə vəziyyətindədir və iki qonşu karbon atomu və bir hidrogen atomu ilə üç σ bağı ilə bağlıdır. Hər bir cüt π bağı arasındakı əlaqə bucaqları 120°-dir. Beləliklə, σ bağlarının skeleti düzgün altıbucaqlıdır, burada bütün karbon atomları və bütün σ bağları C–C və C–H eyni müstəvidə yerləşir:
Bütün karbon atomlarının p-elektronları benzol halqasının σ-skeletinin müstəvisinə perpendikulyar yerləşən qonşu 2p-AO-ların yanal üst-üstə düşməsi ilə bir-biri ilə qarşılıqlı əlaqədə olur. Onlar halqanın müstəvisinin üstündə və altında cəmlənmiş tək siklik π-elektron buludu əmələ gətirirlər.
Benzoldakı bütün C-C bağları ekvivalentdir, onların uzunluğu 0,140 nm-dir, bu, tək bir bağın (0,154 nm) və ikiqat bağın (0,134 nm) uzunluğu arasındakı ara qiymətə uyğundur. Bu o deməkdir ki, benzol molekulunda karbon atomları arasında sırf sadə və qoşa bağlar yoxdur (1865-ci ildə alman kimyaçısı F.Kekule tərəfindən təklif edilən düsturda olduğu kimi) və onların hamısı düzülmüşdür (delokalizasiya, animasiyaya baxın). Buna görə də, benzolun struktur düsturu nizamlı altıbucaqlı (σ-skelet) və onun daxilində delokalizasiya olunmuş π-bağları göstərən dairə kimi təsvir edilmişdir:
Kekule düsturu da tez-tez istifadə olunur, lakin onun yalnız şərti olaraq molekulun quruluşunu çatdırdığı nəzərə alınır.
2. Benzol homoloqları. Nomenklatura və izomeriya
Benzol homoloqları, benzol molekulunda bir və ya bir neçə hidrogen atomunun karbohidrogen radikalları (R) ilə əvəzlənməsi nəticəsində yaranan birləşmələrdir:
Benzolun homoloji seriyasının ümumi düsturuCnH2n-6(n ≥ 6).
Nomenklatura. Trivial adlar geniş istifadə olunur (toluol, ksilen, kumen və s.). Sistemli adlar karbohidrogen radikalının (prefiks) və sözün adından qurulur benzol(kök):
C 6 H 5 -CH 3 C 6 H 5 -C 2 H 5 C 6 H 5 -C 3 H 7
Metilbenzol (toluol) etilbenzol propilbenzol
İki və ya daha çox radikal varsa, onların mövqeyi bağlı olduqları halqadakı karbon atomlarının nömrələri ilə göstərilir. Halqanın nömrələnməsi radikalların sayının ən kiçik olması üçün aparılır. Məsələn:
Əvəz edilməmiş benzollar üçün R-C 6 H 4 -R Adların qurulması üçün başqa bir üsul da istifadə olunur, burada əvəzedicilərin mövqeyi prefikslərlə birləşmənin mənasız adından əvvəl göstərilir:
orto- (O-) halqanın qonşu karbon atomlarında əvəzedicilər, yəni. 1,2-;
meta- (m-) bir karbon atomu vasitəsilə əvəzedicilər (1,3-);
cüt- (n-) halqanın əks tərəflərindəki əvəzedicilər (1,4-).
Aromatik monovalent radikalların ümumi adı var " aril". Bunlardan ikisi üzvi birləşmələrin nomenklaturasında ən çox yayılmışdır: C6H5- (fenil) Və C6H5CH2- (benzil).
İzomerizm(struktur):
1) deputatların vəzifələriüçün di-, üç- Və tetra-əvəz edilmiş benzollar (məsələn, O-, m- Və n-ksilenlər);
2) yan zəncirdə karbon skeletiən azı 3 karbon atomu olan:
3) əvəzedicilərin izomeriyası R, R - C 2 H 5 ilə başlayan.
Məsələn, molekulyar düstur C 8 H 10 4 izomer uyğundur:
üç ksilen CH 3 -C 6 H 4 -CH 3 (o-, m-, p-) və etilbenzol C6H5 -C2H5.
Alkilbenzollarda benzol halqasına nisbətən məkan izomeriyası yoxdur.
Aromatik karbohidrogenlərin hazırlanması
Aromatik karbohidrogenlərin əsas təbii mənbələri bunlardır kömür və neft.
Arenlərin istehsalı üçün reaksiyalar karbohidrogenlərin müxtəlif qrupları arasındakı əlaqəni və onların bir-birinə çevrilmə imkanlarını göstərir.