Koncept "benzenskog prstena" odmah zahtijeva dekodiranje. Da biste to učinili, potrebno je barem ukratko razmotriti strukturu molekule benzena. Prvu strukturu benzena predložio je 1865. njemački znanstvenik A. Kekule:
U najvažnije aromatske ugljikovodike spadaju benzen C 6 H 6 i njegovi homolozi: toluen C 6 H 5 CH 3, ksilen C 6 H 4 (CH 3) 2 itd.; naftalen C 10 H 8, antracen C 14 H 10 i njihovi derivati.
Atomi ugljika u molekuli benzena tvore pravilan ravni šesterokut, iako se on obično crta kao izduženi.
Struktura molekule benzena konačno je potvrđena reakcijom njegovog nastanka iz acetilena. Strukturna formula prikazuje tri jednostruke i tri dvostruke izmjenične ugljik-ugljik veze. Ali takva slika ne prenosi pravu strukturu molekule. U stvarnosti, veze ugljik-ugljik u benzenu su ekvivalentne i imaju svojstva koja se razlikuju od jednostrukih ili dvostrukih veza. Ove se značajke objašnjavaju elektronskom strukturom molekule benzena.
Elektronska struktura benzena
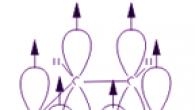
Svaki atom ugljika u molekuli benzena je u stanju sp 2 hibridizacije. S dva susjedna atoma ugljika i atomom vodika povezan je s tri σ veze. Rezultat je ravni šesterokut: svih šest ugljikovih atoma i sve σ-veze C-C i C-H leže u istoj ravnini. Elektronski oblak četvrtog elektrona (p-elektron), koji nije uključen u hibridizaciju, ima oblik bučice i orijentiran je okomito na ravninu benzenskog prstena. Takvi p-elektronski oblaci susjednih ugljikovih atoma preklapaju se iznad i ispod ravnine prstena.

Kao rezultat toga, šest p-elektrona tvori zajednički elektronski oblak i jednu kemijsku vezu za sve atome ugljika. Dva područja velike elektronske ravnine nalaze se s obje strane ravnine σ veze.

Oblak p-elektrona uzrokuje smanjenje udaljenosti između atoma ugljika. U molekuli benzena oni su isti i jednaki su 0,14 nm. U slučaju jednostruke i dvostruke veze te bi udaljenosti bile 0,154 odnosno 0,134 nm. To znači da u molekuli benzena nema jednostrukih ili dvostrukih veza. Molekula benzena je stabilan šesteročlani ciklus identičnih CH skupina koje leže u istoj ravnini. Sve veze između atoma ugljika u benzenu su ekvivalentne, što određuje karakteristična svojstva benzenskog prstena. To se najtočnije odražava strukturnom formulom benzena u obliku pravilnog šesterokuta s krugom unutar (I). (Krug simbolizira jednakost veza između ugljikovih atoma.) Međutim, Kekuléova formula koja označava dvostruke veze (II) također se često koristi:

Benzenov prsten ima određeni skup svojstava, koja se obično nazivaju aromatičnost.
Homologne serije, izomerija, nomenklatura
Konvencionalno, arene se mogu podijeliti u dva reda. Prvi uključuje derivate benzena (na primjer, toluen ili bifenil), drugi uključuje kondenzirane (polinuklearne) arene (najjednostavniji od njih je naftalen):

Homologni niz benzena ima opću formulu C n H 2 n -6. Homolozima se mogu smatrati derivati benzena u kojima je jedan ili više atoma vodika zamijenjeno različitim radikalima ugljikovodika. Na primjer, C6H5-CH3-metilbenzen ili toluen, C6H4(CH3)2-dimetilbenzen ili ksilen, C6H5-C2H5-etilbenzen itd.

Budući da su svi atomi ugljika u benzenu ekvivalentni, njegov prvi homolog, toluen, nema izomere. Drugi homolog, dimetilbenzen, ima tri izomera koji se razlikuju po relativnom rasporedu metilnih skupina (supstituenata). Ovo je orto- (skraćeno o-) ili 1,2-izomer, u kojem se supstituenti nalaze na susjednim atomima ugljika. Ako su supstituenti odvojeni s jednim atomom ugljika, tada se radi o meta- (skraćeno m-) ili 1,3-izomeru, a ako su odvojeni s dva atoma ugljika, tada se radi o para- (skraćeno p-) odn. 1,4-izomer. U imenima se supstituenti označavaju slovima (o-, m-, p-) ili brojevima.

Fizička svojstva
Prvi članovi homolognog niza benzena su bezbojne tekućine specifičnog mirisa. Gustoća im je manja od 1 (lakši od vode). Netopljivo u vodi. Benzen i njegovi homolozi sami su dobra otapala za mnoge organske tvari. Arene gore zadimljenim plamenom zbog visokog sadržaja ugljika u svojim molekulama.
Kemijska svojstva
Aromatičnost određuje kemijska svojstva benzena i njegovih homologa. Sustav sa šest elektrona π je stabilniji od običnih dvoelektronskih π veza. Stoga su reakcije adicije rjeđe za aromatske ugljikovodike nego za nezasićene ugljikovodike. Najkarakterističnije reakcije za arene su supstitucijske reakcije. Dakle, aromatski ugljikovodici po svojim kemijskim svojstvima zauzimaju srednji položaj između zasićenih i nezasićenih ugljikovodika.
I. Supstitucijske reakcije
1. Halogeniranje (s Cl 2, Br 2)

2. Nitriranje

3. Sulfoniranje

4. Alkilacija (nastaju homolozi benzena) - Friedel-Craftsove reakcije

Alkiliranje benzena također se događa kada reagira s alkenima:

Stiren (vinilbenzen) se dobiva dehidrogenacijom etilbenzena:

II. Reakcije adicije
1. Hidrogenizacija

2. Kloriranje

III. Reakcije oksidacije
1. Izgaranje
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Oksidacija pod utjecajem KMnO 4, K 2 Cr 2 O 7, HNO 3 itd.
Ne dolazi do kemijske reakcije (slično alkanima).
Svojstva homologa benzena
U homolozima benzena razlikuju se jezgra i bočni lanac (alkilni radikali). Kemijska svojstva alkilnih radikala slična su alkanima; utjecaj benzenskog prstena na njih očituje se u činjenici da reakcije supstitucije uvijek uključuju atome vodika na atomu ugljika koji je izravno vezan na benzenski prsten, kao i u lakšoj oksidaciji C-H veza.

Učinak alkilnog radikala koji donira elektron (na primjer, -CH3) na benzenski prsten očituje se u povećanju efektivnih negativnih naboja na ugljikovim atomima u orto i para položaju; kao rezultat, zamjena povezanih vodikovih atoma je olakšana. Stoga homolozi benzena mogu tvoriti trisupstituirane produkte (a benzen obično tvori monosupstituirane derivate).
Fizička svojstva
Benzen i njegovi najbliži homolozi su bezbojne tekućine specifičnog mirisa. Aromatični ugljikovodici lakši su od vode i ne otapaju se u njoj, ali su lako topljivi u organskim otapalima – alkoholu, eteru, acetonu.
Benzen i njegovi homolozi sami su dobra otapala za mnoge organske tvari. Sve arene gore zadimljenim plamenom zbog visokog sadržaja ugljika u njihovim molekulama.
Fizička svojstva nekih borilišta prikazana su u tablici.
Stol. Fizička svojstva nekih borilišta
|
Ime |
Formula |
t°.pl., |
t°.b.p., |
|
Benzen |
C6H6 |
5,5 |
80,1 |
|
Toluen (metilbenzen) |
C6H5CH3 |
95,0 |
110,6 |
|
Etilbenzen |
C6H5C2H5 |
95,0 |
136,2 |
|
ksilen (dimetilbenzen) |
C6H4(CH3)2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
par- |
13,26 |
138,35 |
|
|
propilbenzen |
C6H5(CH2)2CH3 |
99,0 |
159,20 |
|
kumen (izopropilbenzen) |
C6H5CH(CH3)2 |
96,0 |
152,39 |
|
stiren (vinilbenzen) |
C6H5CH=CH2 |
30,6 |
145,2 |
Benzen – nisko ključanje ( tbala= 80,1°C), bezbojna tekućina, netopljiva u vodi
Pažnja! Benzen – otrov, utječe na bubrege, mijenja krvnu formulu (uz produljenu izloženost), može poremetiti strukturu kromosoma.
Većina aromatskih ugljikovodika je opasna po život i otrovna.
Dobivanje arena (benzen i njegovi homolozi)
U laboratoriju
1. Fuzija soli benzojeve kiseline s čvrstim alkalijama
C6H5-COONa + NaOH t → C6H6 + Na2CO3
natrijev benzoat
2. Wurtz-Fittingova reakcija: (ovdje je G halogen)
C 6H 5 -G + 2Na + R-G →C 6 H 5 - R + 2 NaG
S 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
U industriji
- izoliran iz nafte i ugljena frakcijskom destilacijom i reformingom;
- od katrana ugljena i koksnog plina
1. Dehidrociklizacija alkana s više od 6 atoma ugljika:
C6H14 t , kat→C 6 H 6 + 4H 2
2. Trimerizacija acetilena(samo za benzen) – r. Zelinsky:
3S 2 H 2 600°C, djelovati. ugljen→C 6 H 6
3. Dehidrogenacija cikloheksan i njegovi homolozi:
Sovjetski akademik Nikolaj Dmitrijevič Zelinski ustanovio je da benzen nastaje iz cikloheksana (dehidrogenacijom cikloalkana
C6H12 t, kat→C 6 H 6 + 3H 2

C6H11-CH3 t , kat→C 6 H 5 -CH 3 + 3H 2
metilcikloheksantoluen
4. Alkilacija benzena(priprava homologa benzena) – r Friedel-Crafts.
C6H6 + C2H5-Cl t, AlCl3→C6H5-C2H5 + HCl
kloretan etilbenzen

Kemijska svojstva arena
ja. REAKCIJE OKSIDACIJE
1. Izgaranje (dimeći plamen):
2C6H6 + 15O2 t→12CO 2 + 6H 2 O + Q
2. U normalnim uvjetima benzen ne mijenja boju bromne vode i vodene otopine kalijevog permanganata
3. Homolozi benzena oksidiraju se kalijevim permanganatom (obojite kalijev permanganat):
A) u kiseloj sredini u benzojevu kiselinu
Kada su homolozi benzena izloženi kalijevom permanganatu i drugim jakim oksidirajućim sredstvima, bočni lanci se oksidiraju. Bez obzira koliko je složen lanac supstituenta, on se uništava, s izuzetkom a-ugljikovog atoma, koji se oksidira u karboksilnu skupinu.
Homolozi benzena s jednim bočnim lancem daju benzojevu kiselinu:
Homolozi koji sadrže dva bočna lanca daju dibazične kiseline:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Pojednostavljeno :
C6H5-CH3+30 KMnO4→C 6 H 5 COOH + H 2 O
B) u neutralnim i blago alkalnim do soli benzojeve kiseline
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. ADICIJE REAKCIJE (tvrđi od alkena)
1. Halogeniranje
C6H6 +3Cl2 h ν → C6H6Cl6 (heksaklorocikloheksan - heksakloran)
2. Hidrogenizacija
C6H6 + 3H2 t , PtiliNi→C 6 H 12 (cikloheksan)
3. Polimerizacija
III. REAKCIJE ZAMJENE – ionski mehanizam (lakši od alkana)
b) homolozi benzena nakon zračenja ili zagrijavanja
Kemijska svojstva alkilnih radikala slična su alkanima. Atomi vodika u njima su slobodnim radikalskim mehanizmom zamijenjeni halogenom. Stoga, u nedostatku katalizatora, nakon zagrijavanja ili UV zračenja, dolazi do reakcije radikalne supstitucije u bočnom lancu. Utjecaj benzenskog prstena na alkilne supstituente dovodi do činjenice da Atom vodika uvijek je zamijenjen na atomu ugljika koji je izravno vezan na benzenski prsten (a-ugljikov atom).
1) C6H5-CH3 + Cl2 h ν → C6H5-CH2-Cl + HCl
c) homolozi benzena u prisutnosti katalizatora
C6H5-CH3 + Cl2 AlCl 3 → (orta smjesa, par derivata) +HCl
2. Nitracija (s dušičnom kiselinom)
C6H6 + HO-NO2 t, H2SO4→C6H5-NO2 + H2O
nitrobenzen - miris bademi!
C6H5-CH3 + 3HO-NO2 t, H2SO4→ S H3-C6H2 (NO2)3 + 3H202,4,6-trinitrotoluen (tol, TNT)
Primjena benzena i njegovih homologa
Benzen C6H6 je dobro otapalo. Benzen kao aditiv poboljšava kvalitetu motornog goriva. Služi kao sirovina za proizvodnju mnogih aromatskih organskih spojeva - nitrobenzena C 6 H 5 NO 2 (otapalo iz kojeg se dobiva anilin), klorobenzena C 6 H 5 Cl, fenola C 6 H 5 OH, stirena itd.
Toluen C 6 H 5 –CH 3 – otapalo, koristi se u proizvodnji boja, lijekova i eksploziva (TNT (TNT), ili 2,4,6-trinitrotoluen TNT).
Ksileni C6H4(CH3)2. Tehnički ksilen je mješavina tri izomera ( orto-, meta- I par-ksileni) – koristi se kao otapalo i početni produkt za sintezu mnogih organskih spojeva.
izopropilbenzen C 6 H 5 –CH(CH 3) 2 koristi se za proizvodnju fenola i acetona.
Klorirani derivati benzena koristi se za zaštitu bilja. Dakle, produkt zamjene H atoma u benzenu s atomima klora je heksaklorobenzen C 6 Cl 6 - fungicid; koristi se za suho tretiranje sjemena pšenice i raži protiv plamenjače. Produkt adicije klora na benzen je heksaklorocikloheksan (heksakloran) C 6 H 6 Cl 6 - insekticid; koristi se za suzbijanje štetnih insekata. Navedene tvari spadaju u pesticide – kemijska sredstva za suzbijanje mikroorganizama, biljaka i životinja.
Stiren C 6 H 5 – CH = CH 2 vrlo lako polimerizira, tvoreći polistiren, a pri kopolimerizaciji s butadienom, stiren-butadien gume.
VIDEO ISKUSTVA
Areni ili aromatični(benzenoidni) ugljikovodici su spojevi čije molekule sadrže stabilne cikličke skupine atoma (benzenske prstenove) sa zatvorenim sustavom konjugiranih veza.
Aromatski karakter arena objašnjava se elektronskom strukturom benzenskog prstena.
Kriteriji aromatičnosti. Na temelju proučavanja cikličkih konjugiranih sustava utvrđeno je da je spoj aromatičan ako se pridržava Hückelovo pravilo: Povećanu termodinamičku stabilnost (aromatičnost) imaju samo monociklički konjugirani sustavi (polieni) koji imaju planarnu strukturu i sadrže 4n + 2 -elektrona u zatvorenom konjugacijskom lancu (gdje je n cijeli broj: 0, 1, 2, 3, itd.). Prstenovi koji sadrže 4n -elektrona su antiaromatski (destabilizirani).
Uvjeti aromatičnosti Potpuno odgovara molekuli benzena C 6 H 6, u čijem sustavu konjugacije sudjeluje 6 -elektrona - aromatski sekstet (prema formuli 4n + 2 s n = 1). Aromatični prstenovi mnogo su stabilniji od svojih konjugiranih acikličkih analoga s istim brojem π-elektrona, tj. benzen je stabilniji od CH 2 =CH–CH=CH–CH=CH 2 (heksatrien-1,3,5).
Nomenklatura. Široko se koriste trivijalni nazivi (toluen, ksilen, kumen itd.). Sustavni nazivi homologa benzena grade se od naziva ugljikovodičnog radikala (prefiks) i riječi benzen (korijen): C 6 H 5 - CH 3 - metilbenzen (toluen), C 6 H 5 - C 2 H 5 - etilbenzen, C 6 H 5 - CH (CH 3) 2 – izopropilbenzen (kumen). Ako postoje dva ili više radikala, njihov položaj je označen brojevima ugljikovih atoma u prstenu na koji su povezani. Numeriranje prstena provodi se tako da je broj radikala najmanji.
Za disupstituirane benzene RC 6 H 4 R koristi se i druga metoda konstruiranja naziva, u kojoj se položaj supstituenata navodi ispred trivijalnog naziva spoja s prefiksima: orto-(o-) supstituenti na susjednom ugljiku atoma prstena, tj. u poziciji 1,2-; meta-(m-) supstituenti kroz jedan ugljikov atom (1,3-); para- (p-) supstituenti na suprotnim stranama (1,4-).
Izomerija. U nizu homologa benzena pojavljuje se strukturna izomerija: 1) položaji supstituenata za di-, tri- i tetra-supstituirane benzene (na primjer, o-, m- i p-ksileni); 2) ugljikov kostur u bočnom lancu koji sadrži najmanje 3 atoma ugljika (C6H5-CH2CH2CH3-n-propilbenzen i C6H5-CH(CH3)2-izopropilbenzen ili kumen); 3) izomerija supstituenata R, počevši od R = C 2 H 5 (na primjer, molekulska formula C 8 H 10 odgovara 4 izomera: o-, m-, p-ksileni CH 3 C 6 H 4 CH 3 i etilbenzen C 6 H 5 C 2 H 5); 4) međuklasna izomerija s nezasićenim spojevima (na primjer, formula C 6 H 6 osim benzena
imaju spojeve CH 2 =CH–C≡C–CH=CH2, CH≡C–CH=CH–CH=CH2 itd., kao i nezasićene cikluse). Ne postoji prostorna izomerija u odnosu na benzenski prsten u supstituiranim arenima.
Hückelovo pravilo:
Molekule koje se pokoravaju Hückelovom pravilu su aromatične: planarni monociklički konjugirani sustav koji sadrži (4n + 2)π-elektrona (gdje je n = 0,1,2...) je aromatičan.
Mehanizam elektrofilne supstitucije:
1Faza 1: stvaranje p-kompleksa. U ovom slučaju nastaje slaba veza između p-elektronskog oblaka benzenskog prstena i elektrofilnog reagensa s nedostatkom elektronske gustoće uz zadržavanje aromatskog seksteta. Elektrofilni reagens obično se nalazi okomito na ravninu prstena duž njegove osi simetrije. Ova faza nastupa brzo i ne utječe na brzinu reakcije. Postojanje p-kompleksa dokazano je UV spektroskopijom...
Faza 2: stvaranje b-kompleksa. Ova faza je spora i praktički nepovratna. Između elektrofila i atoma ugljika benzenskog prstena stvara se kovalentna b-veza, a atom ugljika prelazi iz spI u spI-valentno stanje uz prekid aromatskog seksteta i stvaranje cikloheksadienilnog kationa (benzenijevog iona). Benzenov kation zajedno s protuionom tvori ionski spoj koji dobro provodi električnu struju. U benzenovom ionu svi atomi ugljika nalaze se u istoj ravnini, a supstituenti ysp-hibridiziranog atoma ugljika okomiti su na nju.
3. i 4. stupanj: stvaranje drugog p-kompleksa i aromatizacija. B-kompleks se može pretvoriti u novi, malo stabilni p-kompleks, koji se deprotonira pod utjecajem baze, obično protuiona.
Benzen kao predstavnik arena. Struktura molekule benzena. Konjugacija pi-veze. Izomerija i nomenklatura arena. Homolozi benzena. Dobivanje arena, njihova fizikalna svojstva
A RENES (aromatski ugljikovodici)
- Areni ili aromatski ugljikovodici su spojevi čije molekule sadrže stabilne cikličke skupine atoma (benzenske jezgre) sa zatvorenim sustavom konjugiranih veza.
Najjednostavniji predstavnici (jednojezgrene arene):
Višejezgrene arene: naftalin C 10 H 8, antracen C 14 N 10 itd.Izraz "aromatični spojevi" nastao je davno zbog činjenice da neki predstavnici ove serije tvari imaju ugodan miris. Međutim, danas pojam "aromatičnost" ima potpuno drugačije značenje.Aromatičnost molekule znači njezinu povećanu stabilnost, zbog delokalizacije π-elektrona u cikličkom sustavu.Arene kriteriji aromatičnosti:
- Atomi ugljika u sp 2 hibridiziranom stanju tvore ciklički sustav.
- Atomi ugljika nalaze se u istoj ravnini (ciklus ima ravnu strukturu).
- Zatvoreni sustav konjugiranih veza sadrži
- 4n+2π elektrona ( n– cijeli broj).
Molekula benzena u potpunosti zadovoljava ove kriterije. C 6 H 6.
1. Struktura benzena
Benzen C 6 H 6– predak aromatskih ugljikovodika.
Svaki od šest atoma ugljika u svojoj molekuli nalazi se u stanju sp 2 hibridizacije i povezan je s dva susjedna atoma ugljika i atomom vodika s tri σ veze. Vezni kutovi između svakog para π veza su 120°. Dakle, kostur σ veza je pravilan šesterokut u kojem svi atomi ugljika i sve σ veze C–C i C–H leže u istoj ravnini:
P-elektroni svih ugljikovih atoma međusobno djeluju bočnim preklapanjem susjednih 2p-AO smještenih okomito na ravninu σ-kostura benzenskog prstena. Oni tvore jedan ciklički oblak π-elektrona koncentriran iznad i ispod ravnine prstena.
Sve C–C veze u benzenu su ekvivalentne, njihova duljina je 0,140 nm, što odgovara srednjoj vrijednosti između duljine jednostruke veze (0,154 nm) i dvostruke veze (0,134 nm). To znači da u molekuli benzena ne postoje čisto jednostavne i dvostruke veze između atoma ugljika (kao u formuli koju je 1865. predložio njemački kemičar F. Kekule), te su sve poravnate (delokalizirane, vidi animaciju). Stoga je strukturna formula benzena prikazana kao pravilan šesterokut (σ-kostur) i krug unutar njega, što označava delokalizirane π-veze:
Često se koristi i Kekuleova formula, ali se uzima u obzir da ona samo uvjetno prenosi strukturu molekule.
2. Homolozi benzena. Nomenklatura i izomerija
Homolozi benzena su spojevi nastali zamjenom jednog ili više vodikovih atoma u molekuli benzena ugljikovodičnim radikalima (R):
Opća formula homolognog niza benzenaCnH2n-6(n ≥ 6).
Nomenklatura. Široko se koriste trivijalni nazivi (toluen, ksilen, kumen itd.). Sustavni nazivi grade se od naziva ugljikovodičnog radikala (prefiksa) i riječi benzen(korijen):
C6H5-CH3 C6H5-C2H5C6H5-C3H7
metilbenzen (toluen) etilbenzen propilbenzen
Ako postoje dva ili više radikala, njihov položaj je označen brojevima ugljikovih atoma u prstenu na koji su vezani. Numeriranje prstena provodi se tako da je broj radikala najmanji. Na primjer:
Za disupstituirane benzene R-C6H4-R Također se koristi druga metoda konstruiranja imena, u kojoj je položaj supstituenata naznačen ispred trivijalnog naziva spoja s prefiksima:
orto- (O-) supstituenti na susjednim ugljikovim atomima prstena, tj. 1,2-;
meta- (m-) supstituenti kroz jedan ugljikov atom (1,3-);
par- (n-) supstituenti na suprotnim stranama prstena (1,4-).
Aromatski monovalentni radikali imaju zajednički naziv " aril". Od njih su dva najčešća u nomenklaturi organskih spojeva: C6H5- (fenil) I C6H5CH2- (benzil).
Izomerija(strukturni):
1) mjesta zamjenika Za di-, tri- I tetra- supstituirani benzeni (npr. O-, m- I n-ksileni);
2) ugljični kostur u bočnom lancu koji sadrži najmanje 3 atoma ugljika:
3) izomerija supstituenata R, počevši s R - C2H5.
Na primjer, molekularna formula C 8 H 10 4 izomera odgovaraju:
tri ksilena CH3-C6H4-CH3 (o-, m-, p-) i etilbenzen C6H5 -C2H5.
Ne postoji prostorna izomerija u odnosu na benzenski prsten u alkilbenzenima.
Dobivanje aromatskih ugljikovodika
Glavni prirodni izvori aromatskih ugljikovodika su ugljena i nafte.
Reakcije za proizvodnju arena ukazuju na odnos između različitih skupina ugljikovodika i mogućnost njihove transformacije jednih u druge.