"ბენზოლის რგოლის" კონცეფცია დაუყოვნებლივ მოითხოვს დეკოდირებას. ამისათვის საჭიროა მოკლედ მაინც განვიხილოთ ბენზოლის მოლეკულის სტრუქტურა. ბენზოლის პირველი სტრუქტურა შემოგვთავაზა გერმანელმა მეცნიერმა ა.კეკულემ 1865 წელს:
ყველაზე მნიშვნელოვან არომატულ ნახშირწყალბადებს მიეკუთვნება ბენზოლი C 6 H 6 და მისი ჰომოლოგები: ტოლუოლი C 6 H 5 CH 3, ქსილენი C 6 H 4 (CH 3) 2 და სხვ.; ნაფტალინი C 10 H 8, ანტრაცენი C 14 H 10 და მათი წარმოებულები.
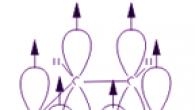
ნახშირბადის ატომები ბენზოლის მოლეკულაში ქმნიან რეგულარულ ბრტყელ ექვსკუთხედს, თუმცა ის ჩვეულებრივ დახატულია როგორც წაგრძელებული.
ბენზოლის მოლეკულის სტრუქტურა საბოლოოდ დადასტურდა აცეტილენისგან მისი წარმოქმნის რეაქციით. სტრუქტურული ფორმულა ასახავს სამ ერთ და სამ ორმაგ მონაცვლეობით ნახშირბად-ნახშირბადის ბმას. მაგრამ ასეთი სურათი არ გადმოსცემს მოლეკულის ნამდვილ სტრუქტურას. სინამდვილეში, ნახშირბად-ნახშირბადის ობლიგაციები ბენზოლში ექვივალენტურია და მათ აქვთ თვისებები, რომლებიც არ ჰგავს ერთ ან ორმაგ ბმებს. ეს მახასიათებლები აიხსნება ბენზოლის მოლეკულის ელექტრონული სტრუქტურით.
ბენზოლის ელექტრონული სტრუქტურა
ბენზოლის მოლეკულაში ნახშირბადის თითოეული ატომი sp 2 ჰიბრიდიზაციის მდგომარეობაშია. იგი დაკავშირებულია ორ მეზობელ ნახშირბადის ატომთან და წყალბადის ატომთან სამი σ ბმით. შედეგი არის ბრტყელი ექვსკუთხედი: ექვსივე ნახშირბადის ატომი და ყველა σ-ბმა C-C და C-H დევს ერთ სიბრტყეში. მეოთხე ელექტრონის (p-ელექტრონის) ელექტრონულ ღრუბელს, რომელიც არ მონაწილეობს ჰიბრიდიზაციაში, ჰანტელის ფორმა აქვს და ორიენტირებულია ბენზოლის რგოლის სიბრტყეზე პერპენდიკულურად. მეზობელი ნახშირბადის ატომების ასეთი p-ელექტრონული ღრუბლები გადახურულია რგოლის სიბრტყის ზემოთ და ქვემოთ.

შედეგად, ექვსი p-ელექტრონი ქმნის საერთო ელექტრონულ ღრუბელს და ერთ ქიმიურ კავშირს ყველა ნახშირბადის ატომისთვის. დიდი ელექტრონული სიბრტყის ორი რეგიონი განლაგებულია σ ბმის სიბრტყის ორივე მხარეს.

p-ელექტრონული ღრუბელი იწვევს ნახშირბადის ატომებს შორის მანძილის შემცირებას. ბენზოლის მოლეკულაში ისინი იგივეა და ტოლია 0,14 ნმ. ერთი და ორმაგი ბმის შემთხვევაში, ეს მანძილი იქნება 0,154 და 0,134 ნმ, შესაბამისად. ეს ნიშნავს, რომ ბენზოლის მოლეკულაში არ არის ერთჯერადი ან ორმაგი ბმები. ბენზოლის მოლეკულა არის იდენტური CH ჯგუფების სტაბილური ექვსწევრიანი ციკლი, რომელიც მდებარეობს იმავე სიბრტყეში. ბენზოლში ნახშირბადის ატომებს შორის ყველა ბმა ექვივალენტურია, რაც განსაზღვრავს ბენზოლის რგოლის დამახასიათებელ თვისებებს. ეს ყველაზე ზუსტად აისახება ბენზოლის სტრუქტურული ფორმულით რეგულარული ექვსკუთხედის სახით წრეში შიგნით (I). (წრე განასახიერებს ნახშირბადის ატომებს შორის ბმების ეკვივალენტობას.) თუმცა, კეკულეს ფორმულა, რომელიც მიუთითებს ორმაგ ბმებზე (II) ასევე ხშირად გამოიყენება:

ბენზოლის რგოლს აქვს თვისებების გარკვეული ნაკრები, რომელსაც ჩვეულებრივ არომატულობას უწოდებენ.
ჰომოლოგიური სერია, იზომერიზმი, ნომენკლატურა
პირობითად, არენები შეიძლება დაიყოს ორ რიგად. პირველი მოიცავს ბენზოლის წარმოებულებს (მაგალითად, ტოლუოლის ან ბიფენილს), მეორე მოიცავს შედედებულ (პოლინუკლეარულ) არენებს (მათგან უმარტივესი ნაფტალინია):

ბენზოლის ჰომოლოგიურ სერიას აქვს ზოგადი ფორმულა C n H 2 n -6. ჰომოლოგები შეიძლება ჩაითვალოს ბენზოლის წარმოებულებად, რომლებშიც წყალბადის ერთი ან მეტი ატომი ჩანაცვლებულია სხვადასხვა ნახშირწყალბადის რადიკალებით. მაგალითად, C 6 H 5 -CH 3 - მეთილბენზოლი ან ტოლუოლი, C 6 H 4 (CH 3) 2 - დიმეთილბენზოლი ან ქსილენი, C 6 H 5 -C 2 H 5 - ეთილბენზოლი და ა.შ.

ვინაიდან ბენზოლში ნახშირბადის ყველა ატომი ექვივალენტურია, მის პირველ ჰომოლოგს, ტოლუენს, არ აქვს იზომერები. მეორე ჰომოლოგს, დიმეთილბენზოლს, აქვს სამი იზომერი, რომლებიც განსხვავდებიან მეთილის ჯგუფების (ჩამნაცვლებლების) შედარებით განლაგებით. ეს არის ორთო- (შემოკლებით o-), ან 1,2-იზომერი, რომელშიც შემცვლელები განლაგებულია მეზობელ ნახშირბადის ატომებზე. თუ შემცვლელები გამოყოფილია ერთი ნახშირბადის ატომით, მაშინ ეს არის მეტა- (შემოკლებით m-) ან 1,3-იზომერი, ხოლო თუ ისინი გამოყოფილია ორი ნახშირბადის ატომით, მაშინ ეს არის პარა- (შემოკლებით p-) ან 1,4-იზომერი. სახელებში შემცვლელები აღინიშნება ასოებით (o-, m-, p-) ან რიცხვებით.

ფიზიკური თვისებები
ბენზოლის ჰომოლოგიური სერიის პირველი წევრები არიან უფერო სითხეები სპეციფიკური სუნით. მათი სიმკვრივე 1-ზე ნაკლებია (უფრო მსუბუქი ვიდრე წყალი). წყალში უხსნადი. ბენზოლი და მისი ჰომოლოგები თავად არიან კარგი გამხსნელები მრავალი ორგანული ნივთიერებისთვის. არენები იწვის კვამლის ალით მათ მოლეკულებში ნახშირბადის მაღალი შემცველობის გამო.
ქიმიური თვისებები
არომატულობა განსაზღვრავს ბენზოლის და მისი ჰომოლოგების ქიმიურ თვისებებს. ექვსელექტრონიანი π სისტემა უფრო სტაბილურია, ვიდრე ჩვეულებრივი ორელექტრონული π ბმები. ამიტომ, დამატების რეაქციები ნაკლებად გავრცელებულია არომატული ნახშირწყალბადებისთვის, ვიდრე უჯერი ნახშირწყალბადებისთვის. არენებისთვის ყველაზე დამახასიათებელი რეაქციებია ჩანაცვლების რეაქციები. ამრიგად, არომატული ნახშირწყალბადები, მათი ქიმიური თვისებებით, იკავებენ შუალედურ ადგილს გაჯერებულ და უჯერი ნახშირწყალბადებს შორის.
I. ჩანაცვლების რეაქციები
1. ჰალოგენაცია (Cl 2, Br 2-ით)

2. ნიტრაცია

3. სულფონაცია

4. ალკილაცია (წარმოიქმნება ბენზოლის ჰომოლოგები) - Friedel-Crafts-ის რეაქციები

ბენზოლის ალკილაცია ასევე ხდება, როდესაც ის რეაგირებს ალკენებთან:

სტირონი (ვინილბენზოლი) მიიღება ეთილბენზოლის გაუწყლოებით:

II. დანამატის რეაქციები
1. ჰიდროგენიზაცია

2. ქლორირება

III. ჟანგვის რეაქციები
1. წვა
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. დაჟანგვა KMnO 4, K 2 Cr 2 O 7, HNO 3 და სხვ.
ქიმიური რეაქცია არ ხდება (ალკანების მსგავსი).
ბენზოლის ჰომოლოგების თვისებები
ბენზოლის ჰომოლოგებში გამოიყოფა ბირთვი და გვერდითი ჯაჭვი (ალკილის რადიკალები). ალკილის რადიკალების ქიმიური თვისებები ალკანების მსგავსია; მათზე ბენზოლის რგოლის გავლენა გამოიხატება იმით, რომ ჩანაცვლების რეაქციები ყოველთვის მოიცავს წყალბადის ატომებს ნახშირბადის ატომში, რომელიც პირდაპირ არის დაკავშირებული ბენზოლის რგოლთან, ასევე C-H ობლიგაციების უფრო ადვილად დაჟანგვაში.

ელექტრონის შემომწირველი ალკილის რადიკალი (მაგალითად, -CH 3) ბენზოლის რგოლზე ვლინდება ნახშირბადის ატომების ეფექტური უარყოფითი მუხტების მატებაში ორთო და პარა პოზიციებზე; შედეგად, წყალბადის ასოცირებული ატომების ჩანაცვლება ხელს უწყობს. მაშასადამე, ბენზოლის ჰომოლოგებს შეუძლიათ შექმნან ტრიშემცვლელი პროდუქტები (და ბენზოლი ჩვეულებრივ აყალიბებს მონოჩანაცვლებულ წარმოებულებს).
ფიზიკური თვისებები
ბენზოლი და მისი უახლოესი ჰომოლოგები არის უფერო სითხეები სპეციფიკური სუნით. არომატული ნახშირწყალბადები წყალზე მსუბუქია და მასში არ იხსნება, მაგრამ ადვილად იხსნება ორგანულ გამხსნელებში - ალკოჰოლში, ეთერში, აცეტონში.
ბენზოლი და მისი ჰომოლოგები თავად არიან კარგი გამხსნელები მრავალი ორგანული ნივთიერებისთვის. ყველა არენა იწვის კვამლის ალით მათ მოლეკულებში ნახშირბადის მაღალი შემცველობის გამო.
ზოგიერთი არენის ფიზიკური თვისებები წარმოდგენილია ცხრილში.
მაგიდა. ზოგიერთი არენის ფიზიკური თვისებები
|
სახელი |
ფორმულა |
t°.pl., |
t°.b.p., |
|
ბენზოლი |
C6H6 |
5,5 |
80,1 |
|
ტოლუენი (მეთილბენზოლი) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
ეთილბენზოლი |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
ქსილენი (დიმეთილბენზოლი) |
C 6 H 4 (CH 3) 2 |
||
|
ორთო- |
25,18 |
144,41 |
|
|
მეტა- |
47,87 |
139,10 |
|
|
წყვილი - |
13,26 |
138,35 |
|
|
პროპილბენზოლი |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
კუმენი (იზოპროპილბენზოლი) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
სტირონი (ვინილბენზოლი) |
C 6 H 5 CH = CH 2 |
30,6 |
145,2 |
ბენზოლი - დაბალი დუღილის ( ტბეილი= 80,1°C), უფერო სითხე, წყალში უხსნადი
ყურადღება! ბენზოლი - შხამი, მოქმედებს თირკმელებზე, ცვლის სისხლის ფორმულას (ხანგრძლივი ზემოქმედებით), შეიძლება დაარღვიოს ქრომოსომების სტრუქტურა.
არომატული ნახშირწყალბადების უმეტესობა სიცოცხლისათვის საშიში და ტოქსიკურია.
არენების მომზადება (ბენზოლი და მისი ჰომოლოგები)
ლაბორატორიაში
1. ბენზოის მჟავას მარილების შერწყმა მყარ ტუტეებთან
C6H5-COONa + NaOH t → C 6 H 6 + Na 2 CO 3
ნატრიუმის ბენზოატი
2. ვურც-ფიტინგის რეაქცია: (აქ G არის ჰალოგენი)
C 6ჰ 5 -G + 2ნა + რ-G →C 6 ჰ 5 - რ + 2 ნაგ
თან 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
ინდუსტრიაში
- ნავთობისა და ნახშირისგან იზოლირებული ფრაქციული დისტილაციით და რეფორმირებით;
- ქვანახშირის ტარიდან და კოქსის ღუმელის გაზიდან
1. ალკანების დეჰიდროციკლიზაცია 6-ზე მეტი ნახშირბადის ატომით:
C6H14 ტ , კატ→C 6 H 6 + 4H 2
2. აცეტილენის ტრიმერიზაცია(მხოლოდ ბენზოლისთვის) - რ. ზელინსკი:
3С 2 H 2 600°C, იმოქმედე. ქვანახშირი→C 6 H 6
3. დეჰიდროგენაციაციკლოჰექსანი და მისი ჰომოლოგები:
საბჭოთა აკადემიკოსმა ნიკოლაი დმიტრიევიჩ ზელინსკიმ დაადგინა, რომ ბენზოლი წარმოიქმნება ციკლოჰექსანისგან (ციკლოალკანების დეჰიდროგენაცია
C6H12 ტ, კატ→C 6 H 6 + 3H 2

C6H11-CH3 ტ , კატ→C 6 H 5 -CH 3 + 3H 2
მეთილციკლოჰექსანტოლუენი
4. ბენზოლის ალკილაცია(ბენზოლის ჰომოლოგების მომზადება) – r Friedel-Crafts.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→C 6 H 5 -C 2 H 5 + HCl
ქლოროეთანი ეთილბენზოლი

არენების ქიმიური თვისებები
მე. ოქსიდაციის რეაქციები
1. წვა (მოწევის ალი):
2C6H6 + 15O2 ტ→12CO 2 + 6H 2 O + Q
2. ნორმალურ პირობებში ბენზოლი არ აფერხებს ბრომიან წყალს და კალიუმის პერმანგანატის წყალხსნარს.
3. ბენზოლის ჰომოლოგები იჟანგება კალიუმის პერმანგანატით (კალიუმის პერმანგანატის ფერის შეცვლა):
ა) მჟავე გარემოში ბენზოის მჟავამდე
როდესაც ბენზოლის ჰომოლოგები ექვემდებარება კალიუმის პერმანგანატს და სხვა ძლიერ ჟანგვის აგენტებს, გვერდითი ჯაჭვები იჟანგება. რაც არ უნდა რთული იყოს შემცვლელის ჯაჭვი, ის ნადგურდება, გარდა a-ნახშირბადის ატომისა, რომელიც იჟანგება კარბოქსილის ჯგუფად.
ბენზოლის ჰომოლოგები ერთი გვერდითი ჯაჭვით იძლევა ბენზოის მჟავას:
ორ გვერდითი ჯაჭვის შემცველი ჰომოლოგები იძლევა ორფუძიან მჟავებს:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
გამარტივებული :
C6H5-CH3+3O KMnO4→C 6 H 5 COOH + H 2 O
ბ) ნეიტრალურ და ოდნავ ტუტე ბენზომჟავას მარილებში
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. დანამატის რეაქციები (უფრო მძიმე ვიდრე ალკენები)
1. ჰალოგენაცია
C 6 H 6 + 3Cl 2 თ ν → C6H6Cl6 (ჰექსაქლოროციკლოჰექსანი - ჰექსაქლორანი)
2. ჰიდროგენიზაცია
C6H6 + 3H2 ტ , პტანნი→C 6 H 12 (ციკლოჰექსანი)
3. პოლიმერიზაცია
III. ჩანაცვლების რეაქციები - იონის მექანიზმი (უფრო მსუბუქი ვიდრე ალკანები)
ბ) ბენზოლის ჰომოლოგები დასხივების ან გაცხელებისას
ალკილის რადიკალების ქიმიური თვისებები მსგავსია ალკანების. მათში წყალბადის ატომები ჰალოგენით იცვლება თავისუფალი რადიკალების მექანიზმით. ამიტომ, კატალიზატორის არარსებობის შემთხვევაში, გაცხელებისას ან ულტრაიისფერი გამოსხივებისას, გვერდითი ჯაჭვში ხდება რადიკალური ჩანაცვლების რეაქცია. ბენზოლის რგოლის გავლენა ალკილის შემცვლელებზე იწვევს იმ ფაქტს, რომ წყალბადის ატომი ყოველთვის იცვლება ნახშირბადის ატომთან, რომელიც პირდაპირ არის დაკავშირებული ბენზოლის რგოლთან (ა-ნახშირბადის ატომი).
1) C 6 H 5 -CH 3 + Cl 2 თ ν → C 6 H 5 -CH 2 -Cl + HCl
გ) ბენზოლის ჰომოლოგები კატალიზატორის თანდასწრებით
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (ორთის ნაზავი, წარმოებულების წყვილი) +HCl
2. ნიტრაცია (აზოტის მჟავით)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
ნიტრობენზოლი - სუნი ნუშის!
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ თან H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-ტრინიტროტოლუენი (ტოლი, TNT)
ბენზოლის და მისი ჰომოლოგების გამოყენება
ბენზოლი C 6 H 6 არის კარგი გამხსნელი. ბენზოლი, როგორც დანამატი, აუმჯობესებს საავტომობილო საწვავის ხარისხს. ის ემსახურება როგორც ნედლეულს მრავალი არომატული ორგანული ნაერთების - ნიტრობენზოლი C 6 H 5 NO 2 (გამხსნელი, საიდანაც მიიღება ანილინი), ქლორობენზოლი C 6 H 5 Cl, ფენოლი C 6 H 5 OH, სტირონი და ა.შ.
ტოლუენი C 6 H 5 -CH 3 - გამხსნელი, რომელიც გამოიყენება საღებავების, სამკურნალო და ფეთქებადი ნივთიერებების წარმოებაში (TNT (TNT), ან 2,4,6-ტრინიტროტოლუენის TNT).
ქსილენები C6H4(CH3)2. ტექნიკური ქსილენი არის სამი იზომერის ნარევი ( ორთო-, მეტა- და წყვილი-ქსილენები) - გამოიყენება როგორც გამხსნელი და საწყისი პროდუქტი მრავალი ორგანული ნაერთის სინთეზისთვის.
იზოპროპილბენზოლი C6H5-CH(CH3)2 გამოიყენება ფენოლისა და აცეტონის წარმოებისთვის.
ბენზოლის ქლორირებული წარმოებულებიგამოიყენება მცენარეთა დაცვისთვის. ამრიგად, H ატომების ბენზოლში ქლორის ატომებით ჩანაცვლების პროდუქტია ჰექსაქლორბენზოლი C 6 Cl 6 - ფუნგიციდი; გამოიყენება ხორბლისა და ჭვავის თესლის მშრალ სამკურნალოდ ჭუჭყის საწინააღმდეგოდ. ბენზოლში ქლორის დამატების პროდუქტია ჰექსაქლოროციკლოჰექსანი (ჰექსაქლორანი) C 6 H 6 Cl 6 - ინსექტიციდი; იგი გამოიყენება მავნე მწერების გასაკონტროლებლად. აღნიშნული ნივთიერებები მიეკუთვნება პესტიციდებს - მიკროორგანიზმებთან, მცენარეებთან და ცხოველებთან ბრძოლის ქიმიურ საშუალებებს.
სტირონი C 6 H 5 – CH = CH 2 ძალიან ადვილად პოლიმერიზდება, წარმოქმნის პოლისტიროლს, ხოლო ბუტადიენთან კოპოლიმერიზაციისას, სტირონ-ბუტადიენის რეზინები.
ვიდეო გამოცდილება
არენები ან არომატული(ბენზოლოიდი) ნახშირწყალბადები არის ნაერთები, რომელთა მოლეკულები შეიცავს ატომების სტაბილურ ციკლურ ჯგუფებს (ბენზოლის რგოლები) კონიუგირებული ბმების დახურული სისტემით.
არენების არომატული ხასიათი აიხსნება ბენზოლის რგოლის ელექტრონული სტრუქტურით.
არომატულობის კრიტერიუმები. ციკლური კონიუგირებული სისტემების შესწავლის საფუძველზე დადგინდა, რომ ნაერთი არის არომატული, თუ ემორჩილება ჰუკელის წესი: გაზრდილი თერმოდინამიკური მდგრადობა (არომატულობა) გააჩნია მხოლოდ მონოციკლურ კონიუგირებულ სისტემებს (პოლიენებს), რომლებსაც აქვთ პლანშეტური სტრუქტურა და შეიცავს 4n + 2 -ელექტრონს დახურულ კონიუგაციის ჯაჭვში (სადაც n არის მთელი რიცხვი: 0, 1, 2, 3, დ). 4n -ელექტრონების შემცველი რგოლები ანტიარომატულია (დესტაბილიზებული).
არომატის პირობებისრულად შეესაბამება ბენზოლის მოლეკულა C 6 H 6, რომლის კონიუგაციის სისტემაში მონაწილეობს 6 -ელექტრონი - არომატული სექსტეტი (ფორმულის მიხედვით 4n + 2 n = 1-ით). არომატული რგოლები ბევრად უფრო სტაბილურია, ვიდრე მათი კონიუგირებული აციკლური ანალოგები იგივე რაოდენობის π-ელექტრონებით, ე.ი. ბენზოლი უფრო სტაბილურია ვიდრე CH2 =CH–CH=CH–CH=CH2 (ჰექსატრიენი-1,3,5).
ნომენკლატურა. ფართოდ გამოიყენება ტრივიალური სახელები (ტოლუენი, ქსილენი, კუმენი და ა.შ.). ბენზოლის ჰომოლოგების სისტემატური სახელები აგებულია ნახშირწყალბადის რადიკალის (პრეფიქსი) და სიტყვის ბენზოლის (ფესვი) სახელიდან: C 6 H 5 - CH 3 - მეთილბენზოლი (ტოლუოლი), C 6 H 5 - C 2 H 5 - ეთილბენზოლი, C 6 H 5 - CH (CH 3) 2 - იზოპროპილბენზოლი (კუმენი). თუ არსებობს ორი ან მეტი რადიკალი, მათი პოზიცია მითითებულია ნახშირბადის ატომების რიცხვით რგოლში, რომელთანაც ისინი დაკავშირებულია. ბეჭდის ნუმერაცია ხორციელდება ისე, რომ რადიკალების რაოდენობა იყოს ყველაზე მცირე.
ჩანაცვლებული ბენზოლებისთვის RC 6 H 4 R ასევე გამოიყენება სახელების აგების სხვა მეთოდი, რომელშიც შემცვლელების პოზიცია მითითებულია ნაერთის ტრივიალურ სახელამდე პრეფიქსებით: ორთო-(ო-) შემცვლელები მეზობელ ნახშირბადზე. ბეჭდის ატომები, ე.ი. პოზიცია 1,2-; მეტა- (მ-) შემცვლელები ნახშირბადის ერთი ატომის მეშვეობით (1,3-); პარა- (p-) შემცვლელები მოპირდაპირე მხარეს (1,4-).
იზომერიზმი. ბენზოლის ჰომოლოგების სერიაში ჩნდება სტრუქტურული იზომერიზმი: 1) დი-, ტრი- და ტეტრა-ჩანაცვლებული ბენზოლების შემცვლელების პოზიციები (მაგალითად, o-, m- და p-ქსილენები); 2) ნახშირბადის ჩონჩხი გვერდით ჯაჭვში, რომელიც შეიცავს მინიმუმ 3 ნახშირბადის ატომს (C 6 H 5 -CH 2 CH 2 CH 3 - n-პროპილბენზოლი და C 6 H 5 -CH (CH 3) 2 - იზოპროპილბენზოლი ან კუმენი); 3) შემცვლელების იზომერიზმი R, დაწყებული R = C 2 H 5-ით (მაგალითად, მოლეკულური ფორმულა C 8 H 10 შეესაბამება 4 იზომერს: o-, m-, p-xylenes CH 3 -C 6 H 4 -CH 3 და ეთილბენზოლი C 6 H 5 C 2 H 5); 4) კლასთაშორისი იზომერიზმი უჯერი ნაერთებით (მაგალითად, ფორმულა C 6 H 6 ბენზოლის გარდა
აქვთ ნაერთები CH 2 =CH–C≡C–CH=CH2, CH≡C–CH=CH–CH=CH2 და ა.შ., ასევე უჯერი ციკლები). ჩანაცვლებულ არენებში ბენზოლის რგოლთან შედარებით სივრცითი იზომერიზმი არ არსებობს.
ჰუკელის წესი:
მოლეკულები, რომლებიც ემორჩილებიან ჰუკელის წესს, არომატულია: პლანშეტური მონოციკლური კონიუგირებული სისტემა, რომელიც შეიცავს (4n + 2)π-ელექტრონებს (სადაც n = 0,1,2...) არის არომატული.
ელექტროფილური ჩანაცვლების მექანიზმი:
1ეტაპი 1: p-კომპლექსის ფორმირება.ამ შემთხვევაში სუსტი ბმა იქმნება ბენზოლის რგოლის p-ელექტრონულ ღრუბელსა და ელექტროფილურ რეაგენტს შორის ელექტრონის სიმკვრივის დეფიციტით, არომატული სექსტეტის შენარჩუნებით. ელექტროფილური რეაგენტი ჩვეულებრივ მდებარეობს რგოლის სიბრტყის პერპენდიკულარულად მისი სიმეტრიის ღერძის გასწვრივ. ეს ეტაპი სწრაფად ვითარდება და არ მოქმედებს რეაქციის სიჩქარეზე. p-კომპლექსის არსებობა დასტურდება UV სპექტროსკოპიით...
ეტაპი 2: b-კომპლექსის ფორმირება. ეს ეტაპი ნელი და პრაქტიკულად შეუქცევადია. ბენზოლის რგოლის ელექტროფილსა და ნახშირბადის ატომს შორის წარმოიქმნება კოვალენტური ბ ბმა, ხოლო ნახშირბადის ატომი spI-დან spI-ვალენტურ მდგომარეობაში გადადის არომატული სექსტეტის დარღვევით და ციკლოჰექსადიენილის კატიონის (ბენზენის იონი) წარმოქმნით. ბენზოლის კატიონი კონტრ იონთან ერთად ქმნის იონურ ნაერთს, რომელიც კარგად ატარებს ელექტრულ დენს. ბენზოლის იონში ნახშირბადის ყველა ატომი განლაგებულია ერთ სიბრტყეში და ysp-ჰიბრიდირებული ნახშირბადის ატომის შემცვლელები მასზე პერპენდიკულარულია.
მე-3 და მე-4 ეტაპები: მეორე პ-კომპლექსის ფორმირება და არომატიზაცია. b-კომპლექსი შეიძლება გარდაიქმნას ახალ, ოდნავ სტაბილურ p-კომპლექსად, რომელიც დეპროტონირებულია ფუძის, ჩვეულებრივ, კონტრაიონის გავლენის ქვეშ.
ბენზოლი, როგორც არენების წარმომადგენელი. ბენზოლის მოლეკულის სტრუქტურა. პი-ბონდის კონიუგაცია. არენების იზომერიზმი და ნომენკლატურა. ბენზოლის ჰომოლოგები. არენების მომზადება, მათი ფიზიკური თვისებები
A RENES (არომატული ნახშირწყალბადები)
- არენები ან არომატული ნახშირწყალბადები არის ნაერთები, რომელთა მოლეკულები შეიცავს ატომების სტაბილურ ციკლურ ჯგუფებს (ბენზოლის ბირთვები) კონიუგირებული ბმების დახურული სისტემით.
უმარტივესი წარმომადგენლები (ერთბირთვიანი არენები):
მრავალბირთვიანი არენები: ნაფტალინი C 10 H 8, ანტრაცინი C 14 N 10და ა.შ.ტერმინი "არომატული ნაერთები" დიდი ხნის წინ გაჩნდა იმის გამო, რომ ამ სერიის ნივთიერებების ზოგიერთ წარმომადგენელს აქვს სასიამოვნო სუნი. თუმცა, დღესდღეობით ცნებას "არომატიულობა" სულ სხვა მნიშვნელობა აქვს.მოლეკულის არომატულობა ნიშნავს მის გაზრდილ სტაბილურობას, ციკლურ სისტემაში π-ელექტრონების დელოკალიზაციის გამო.არენის არომატულობის კრიტერიუმები:
- ნახშირბადის ატომები sp 2 ჰიბრიდულ მდგომარეობაში ქმნიან ციკლურ სისტემას.
- ნახშირბადის ატომები განლაგებულია იმავე სიბრტყეში (ციკლს აქვს ბრტყელი სტრუქტურა).
- კონიუგატური კავშირების დახურული სისტემა შეიცავს
- 4n+2π ელექტრონები ( ნ- მთელი რიცხვი).
ბენზოლის მოლეკულა სრულად აკმაყოფილებს ამ კრიტერიუმებს. C 6 H 6.
1. ბენზოლის სტრუქტურა
ბენზოლი C 6 H 6- არომატული ნახშირწყალბადების წინაპარი.
მის მოლეკულაში ნახშირბადის ექვსი ატომიდან თითოეული იმყოფება sp 2 ჰიბრიდიზაციის მდგომარეობაში და დაკავშირებულია ორ მეზობელ ნახშირბადის ატომთან და წყალბადის ატომთან სამი σ ბმით. ბმის კუთხეები π კავშირების თითოეულ წყვილს შორის არის 120°. ამრიგად, σ ობლიგაციების ჩონჩხი არის რეგულარული ექვსკუთხედი, რომელშიც ნახშირბადის ყველა ატომი და ყველა σ ბმა C–C და C–H დევს ერთ სიბრტყეში:
ყველა ნახშირბადის ატომის p-ელექტრონები ურთიერთქმედებენ ერთმანეთთან მეზობელი 2p-AO-ების გვერდითი გადაფარვით, რომლებიც მდებარეობს ბენზოლის რგოლის σ-ჩონჩხის სიბრტყის პერპენდიკულარულად. ისინი ქმნიან ერთ ციკლურ π-ელექტრონულ ღრუბელს, რომელიც კონცენტრირებულია რგოლის სიბრტყის ზემოთ და ქვემოთ.
ყველა C–C ბმა ბენზოლში არის ეკვივალენტური, მათი სიგრძეა 0,140 ნმ, რაც შეესაბამება შუალედურ მნიშვნელობას ერთი ბმის სიგრძეს (0,154 ნმ) და ორმაგ ბმას (0,134 ნმ) შორის. ეს ნიშნავს, რომ ბენზოლის მოლეკულაში არ არსებობს წმინდად მარტივი და ორმაგი ბმები ნახშირბადის ატომებს შორის (როგორც გერმანელი ქიმიკოსის ფ. კეკულეს მიერ შემოთავაზებული ფორმულა 1865 წელს), და ისინი ყველა გასწორებულია (დელოკალიზებული, იხ. ანიმაცია). მაშასადამე, ბენზოლის სტრუქტურული ფორმულა გამოსახულია როგორც რეგულარული ექვსკუთხედი (σ-ჩონჩხი) და მის შიგნით წრე, რაც მიუთითებს დელოკალიზებულ π-ობლიგაციებზე:
კეკულეს ფორმულა ასევე ხშირად გამოიყენება, მაგრამ მხედველობაში მიიღება, რომ ის მხოლოდ პირობითად გადმოსცემს მოლეკულის სტრუქტურას.
2. ბენზოლის ჰომოლოგები. ნომენკლატურა და იზომერიზმი
ბენზოლის ჰომოლოგები არის ნაერთები, რომლებიც წარმოიქმნება ბენზოლის მოლეკულაში ერთი ან მეტი წყალბადის ატომის ნახშირწყალბადების რადიკალებით (R) ჩანაცვლებით:
ბენზოლის ჰომოლოგიური სერიის ზოგადი ფორმულაCnH2n-6(n ≥ 6).
ნომენკლატურა. ფართოდ გამოიყენება ტრივიალური სახელები (ტოლუენი, ქსილენი, კუმენი და ა.შ.). სისტემატური სახელები აგებულია ნახშირწყალბადის რადიკალის (პრეფიქსი) და სიტყვის სახელიდან ბენზოლი(ფესვი):
C 6 H 5 -CH 3 C 6 H 5 -C 2 H 5 C 6 H 5 - C 3 H 7
მეთილბენზოლი (ტოლუოლი) ეთილბენზოლი პროპილბენზოლი
თუ არსებობს ორი ან მეტი რადიკალი, მათი პოზიცია მითითებულია ნახშირბადის ატომების რიცხვით იმ რგოლში, რომელსაც ისინი უკავშირდება. ბეჭდის ნუმერაცია ხორციელდება ისე, რომ რადიკალების რაოდენობა იყოს ყველაზე მცირე. მაგალითად:
შემცვლელი ბენზოლებისთვის R-C 6 H 4 -Rასევე გამოიყენება სახელების აგების სხვა მეთოდი, რომელშიც შემცვლელების პოზიცია მითითებულია ნაერთის ტრივიალურ სახელამდე პრეფიქსებით:
ორთო- (ო-) შემცვლელები რგოლის მეზობელ ნახშირბადის ატომებზე, ე.ი. 1,2-;
მეტა- (მ-) შემცვლელები ერთი ნახშირბადის ატომით (1,3-);
წყვილი- (ნ-) შემცვლელები რგოლის მოპირდაპირე მხარეს (1,4-).
არომატულ მონოვალენტურ რადიკალებს აქვთ საერთო სახელი " არილიმათგან ორი ყველაზე გავრცელებულია ორგანული ნაერთების ნომენკლატურაში: C6H5- (ფენილი) და C6H5CH2- (ბენზილი).
იზომერიზმი(სტრუქტურული):
1) დეპუტატების თანამდებობებიამისთვის დი-, სამი- და ტეტრა- შემცვლელი ბენზოლები (მაგალითად, ო-, მ- და ნ-ქსილენები);
2) ნახშირბადის ჩონჩხი გვერდით ჯაჭვშიშეიცავს მინიმუმ 3 ნახშირბადის ატომს:
3) შემცვლელთა იზომერიზმი R, დაწყებული R - C 2 H 5-ით.
მაგალითად, მოლეკულური ფორმულა C 8 H 10შეესაბამება 4 იზომერი:
სამი ქსილენი CH 3 -C 6 H 4 -CH 3 (o-, m-, p-) და ეთილბენზოლი C6H5 -C2H5.
ალკილბენზოლებში ბენზოლის რგოლთან შედარებით სივრცითი იზომერიზმი არ არსებობს.
არომატული ნახშირწყალბადების მომზადება
არომატული ნახშირწყალბადების ძირითადი ბუნებრივი წყაროებია ქვანახშირი და ნავთობი.
არენების წარმოებისთვის რეაქციები მიუთითებს ნახშირწყალბადების სხვადასხვა ჯგუფებს შორის ურთიერთობაზე და მათი ერთმანეთში გარდაქმნის შესაძლებლობაზე.