Koncept „benzénového kruhu“ okamžite vyžaduje dekódovanie. K tomu je potrebné aspoň stručne zvážiť štruktúru molekuly benzénu. Prvú štruktúru benzénu navrhol v roku 1865 nemecký vedec A. Kekule:
Medzi najvýznamnejšie aromatické uhľovodíky patrí benzén C 6 H 6 a jeho homológy: toluén C 6 H 5 CH 3, xylén C 6 H 4 (CH 3) 2 atď.; naftalén C 10 H 8, antracén C 14 H 10 a ich deriváty.
Atómy uhlíka v molekule benzénu tvoria pravidelný plochý šesťuholník, hoci sa zvyčajne kreslí ako predĺžený.
Štruktúra molekuly benzénu bola nakoniec potvrdená reakciou jej vzniku z acetylénu. Štruktúrny vzorec znázorňuje tri jednoduché a tri dvojité striedavé väzby uhlík-uhlík. Takýto obraz však nevyjadruje skutočnú štruktúru molekuly. V skutočnosti sú väzby uhlík-uhlík v benzéne ekvivalentné a majú vlastnosti, ktoré sa líšia od vlastností jednoduchých alebo dvojitých väzieb. Tieto vlastnosti sú vysvetlené elektrónovou štruktúrou molekuly benzénu.
Elektrónová štruktúra benzénu
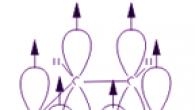
Každý atóm uhlíka v molekule benzénu je v stave hybridizácie sp2. S dvoma susednými atómami uhlíka a atómom vodíka je spojený tromi σ väzbami. Výsledkom je plochý šesťuholník: všetkých šesť atómov uhlíka a všetky σ-väzby C-C a C-H ležia v rovnakej rovine. Elektrónový oblak štvrtého elektrónu (p-elektrónu), ktorý sa nezúčastňuje hybridizácie, má tvar činky a je orientovaný kolmo na rovinu benzénového kruhu. Takéto p-elektrónové oblaky susedných atómov uhlíka sa prekrývajú nad a pod rovinou kruhu.

Výsledkom je, že šesť p-elektrónov tvorí spoločný elektrónový oblak a jedinú chemickú väzbu pre všetky atómy uhlíka. Dve oblasti veľkej elektrónovej roviny sú umiestnené na oboch stranách roviny väzby σ.

Oblak p-elektrónov spôsobuje zmenšenie vzdialenosti medzi atómami uhlíka. V molekule benzénu sú rovnaké a rovnajú sa 0,14 nm. V prípade jednoduchej a dvojitej väzby by tieto vzdialenosti boli 0,154 a 0,134 nm. To znamená, že v molekule benzénu nie sú jednoduché ani dvojité väzby. Molekula benzénu je stabilný šesťčlenný cyklus identických skupín CH ležiacich v rovnakej rovine. Všetky väzby medzi atómami uhlíka v benzéne sú ekvivalentné, čo určuje charakteristické vlastnosti benzénového kruhu. Najpresnejšie to odráža štruktúrny vzorec benzénu vo forme pravidelného šesťuholníka s kruhom vo vnútri (I). (Kruh symbolizuje ekvivalenciu väzieb medzi atómami uhlíka.) Často sa však používa aj Kekulého vzorec označujúci dvojité väzby (II):

Benzénový kruh má určitý súbor vlastností, ktoré sa bežne nazývajú aromatickosť.
Homológny rad, izoméria, nomenklatúra
Tradične môžu byť arény rozdelené do dvoch radov. Prvý zahŕňa deriváty benzénu (napríklad toluén alebo bifenyl), druhý zahŕňa kondenzované (polyjadrové) arény (najjednoduchší z nich je naftalén):

Homológny rad benzénu má všeobecný vzorec C n H 2 n -6. Homológy možno považovať za deriváty benzénu, v ktorých je jeden alebo viac atómov vodíka nahradených rôznymi uhľovodíkovými radikálmi. Napríklad C6H5-CH3-metylbenzén alebo toluén, C6H4(CH3)2-dimetylbenzén alebo xylén, C6H5-C2H5-etylbenzén atď.

Pretože všetky atómy uhlíka v benzéne sú ekvivalentné, jeho prvý homológ, toluén, nemá žiadne izoméry. Druhý homológ, dimetylbenzén, má tri izoméry, líšiace sa relatívnym usporiadaním metylových skupín (substituentov). Ide o orto- (skrátene o-) alebo 1,2-izomér, v ktorom sú substituenty umiestnené na susedných atómoch uhlíka. Ak sú substituenty oddelené jedným atómom uhlíka, potom ide o meta- (skrátene m-) alebo 1,3-izomér a ak sú oddelené dvoma atómami uhlíka, potom ide o para- (skrátene p-) resp. 1,4-izomér. V názvoch sú substituenty označené písmenami (o-, m-, p-) alebo číslami.

Fyzikálne vlastnosti
Prvými členmi homologickej série benzénu sú bezfarebné kvapaliny so špecifickým zápachom. Ich hustota je menšia ako 1 (ľahšia ako voda). Nerozpustný vo vode. Benzén a jeho homológy sú samy o sebe dobrými rozpúšťadlami pre mnohé organické látky. Arény horia dymovým plameňom kvôli vysokému obsahu uhlíka v ich molekulách.
Chemické vlastnosti
Aromatickosť určuje chemické vlastnosti benzénu a jeho homológov. Šesťelektrónový π systém je stabilnejší ako bežné dvojelektrónové π väzby. Preto sú adičné reakcie pre aromatické uhľovodíky menej bežné ako pre nenasýtené uhľovodíky. Najcharakteristickejšími reakciami pre arény sú substitučné reakcie. Aromatické uhľovodíky teda vo svojich chemických vlastnostiach zaujímajú medzipolohu medzi nasýtenými a nenasýtenými uhľovodíkmi.
I. Substitučné reakcie
1. Halogenácia (s Cl2, Br2)

2. Nitrácia

3. Sulfonácia

4. Alkylácia (vznikajú benzénové homológy) - Friedel-Craftsove reakcie

Alkylácia benzénu sa vyskytuje aj vtedy, keď reaguje s alkénmi:

Styrén (vinylbenzén) sa získava dehydrogenáciou etylbenzénu:

II. Adičné reakcie
1. Hydrogenácia

2. Chlorácia

III. Oxidačné reakcie
1. Spaľovanie
2C6H6 + 15O2 → 12CO2 + 6H20
2. Oxidácia vplyvom KMnO 4, K 2 Cr 2 O 7, HNO 3 atď.
Nedochádza k žiadnej chemickej reakcii (podobne ako pri alkánoch).
Vlastnosti benzénových homológov
V benzénových homológoch sa rozlišuje jadro a bočný reťazec (alkylové radikály). Chemické vlastnosti alkylových radikálov sú podobné ako u alkánov; vplyv benzénového kruhu na ne sa prejavuje v tom, že pri substitučných reakciách sa vždy zúčastňujú atómy vodíka na atóme uhlíka priamo viazanom na benzénový kruh, ako aj v ľahšej oxidácii väzieb C-H.

Vplyv elektrón-donorového alkylového radikálu (napríklad -CH3) na benzénový kruh sa prejavuje zvýšením efektívnych záporných nábojov na atómoch uhlíka v orto a para polohách; v dôsledku toho je uľahčená náhrada asociovaných atómov vodíka. Preto homológy benzénu môžu tvoriť trisubstituované produkty (a benzén zvyčajne tvorí monosubstituované deriváty).
Fyzikálne vlastnosti
Benzén a jeho najbližšie homológy sú bezfarebné kvapaliny so špecifickým zápachom. Aromatické uhľovodíky sú ľahšie ako voda a nerozpúšťajú sa v nej, ale ľahko sa rozpúšťajú v organických rozpúšťadlách - alkohol, éter, acetón.
Benzén a jeho homológy sú samy o sebe dobrými rozpúšťadlami pre mnohé organické látky. Všetky arény horia dymovým plameňom kvôli vysokému obsahu uhlíka v ich molekulách.
Fyzikálne vlastnosti niektorých arén sú uvedené v tabuľke.
Tabuľka. Fyzikálne vlastnosti niektorých arén
|
Meno |
Vzorec |
t°.pl., |
t°.b.p., |
|
benzén |
C6H6 |
5,5 |
80,1 |
|
toluén (metylbenzén) |
C6H5CH3 |
95,0 |
110,6 |
|
Etylbenzén |
C6H5C2H5 |
95,0 |
136,2 |
|
Xylén (dimetylbenzén) |
C6H4(CH3)2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
pár- |
13,26 |
138,35 |
|
|
Propylbenzén |
C6H5(CH2)2CH3 |
99,0 |
159,20 |
|
Kumén (izopropylbenzén) |
C6H5CH(CH3)2 |
96,0 |
152,39 |
|
Styrén (vinylbenzén) |
C6H5CH=CH2 |
30,6 |
145,2 |
benzén – nízka teplota varu ( tbalík= 80,1°C), bezfarebná kvapalina, nerozpustná vo vode
Pozor! benzén – jed, pôsobí na obličky, mení zloženie krvi (pri dlhšej expozícii), môže narušiť štruktúru chromozómov.
Väčšina aromatických uhľovodíkov je životu nebezpečná a toxická.
Príprava arénov (benzén a jeho homológy)
V laboratóriu
1. Fúzia solí kyseliny benzoovej s pevnými zásadami
C6H5-COONa + NaOH t → C6H6 + Na2C03
benzoan sodný
2. Wurtz-Fittingova reakcia: (tu G je halogén)
C 6H 5 -G + 2Na + R-G →C 6 H 5 - R + 2 NaG
S 6 H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
V priemysle
- izolované z ropy a uhlia frakčnou destiláciou a reformovaním;
- z uhoľného dechtu a koksárenského plynu
1. Dehydrocyklizácia alkánov s viac ako 6 atómami uhlíka:
C6H14 t , kat->C6H6 + 4H2
2. Trimerizácia acetylénu(iba pre benzén) – r. Zelinského:
3С 2 H 2 600°C, konať. uhlia→C6H6
3. Dehydrogenácia cyklohexán a jeho homológy:
Sovietsky akademik Nikolaj Dmitrievič Zelinskij zistil, že benzén vzniká z cyklohexánu (dehydrogenácia cykloalkánov
C6H12 t, kat->C6H6 + 3H2

C6H11-CH3 t , kat->C6H5-CH3 + 3H2
metylcyklohexán
4. Alkylácia benzénu(príprava benzénových homológov) – r Friedel-Crafts.
C6H6 + C2H5-Cl t, AICI3->C6H5-C2H5 + HCl
chlóretán etylbenzén

Chemické vlastnosti arénov
ja. OXIDAČNÉ REAKCIE
1. Spaľovanie (fajčiarsky plameň):
2C6H6 + 1502 t->12C02 + 6H20 + Q
2. Za normálnych podmienok benzén neodfarbuje brómovú vodu a vodný roztok manganistanu draselného
3. Benzénové homológy sú oxidované manganistanom draselným (odfarbujú manganistan draselný):
A) v kyslom prostredí na kyselinu benzoovú
Keď sú homológy benzénu vystavené manganistanu draselnému a iným silným oxidačným činidlám, bočné reťazce sa oxidujú. Bez ohľadu na to, aký zložitý je reťazec substituenta, je zničený, s výnimkou a-uhlíkového atómu, ktorý je oxidovaný na karboxylovú skupinu.
Homológy benzénu s jedným bočným reťazcom poskytujú kyselinu benzoovú:
Homológy obsahujúce dva bočné reťazce poskytujú dvojsýtne kyseliny:
5C6H5-C2H5 + 12KMnO4 + 18H2S04 → 5C6H5COOH + 5CO2 + 6K2S04 + 12MnS04 +28H20
5C6H5-CH3 + 6KMnO4 + 9H2S04 → 5C6H5COOH + 3K2S04 + 6MnS04 + 14H20
Zjednodušené :
C6H5-CH3+30 KMnO4→C6H5COOH + H20
B) v neutrálnych a mierne alkalických soliach kyseliny benzoovej
C6H5-CH3 + 2KMnO4 → C6H5COO K + KOH + 2Mn02 + H20
II. PRIDACIE REAKCIE (tvrdšie ako alkény)
1. Halogenácia
C6H6+3CI2 h ν → C6H6CI6 (hexachlórcyklohexán - hexachlóran)
2. Hydrogenácia
C6H6 + 3H2 t , PtaleboNi→C6H12 (cyklohexán)
3. Polymerizácia
III. SUBSTITUČNÉ REAKCIE - iónový mechanizmus (ľahší ako alkány)
b) benzénové homológy po ožiarení alebo zahrievaní
Chemické vlastnosti alkylových radikálov sú podobné alkánom. Atómy vodíka v nich sú nahradené halogénom mechanizmom voľných radikálov. Preto v neprítomnosti katalyzátora pri zahrievaní alebo UV ožiarení dochádza v postrannom reťazci k radikálovej substitučnej reakcii. Vplyv benzénového kruhu na alkylové substituenty vedie k tomu, že Atóm vodíka je vždy nahradený na atóme uhlíka priamo viazanom na benzénový kruh (a-atóm uhlíka).
1) C6H5-CH3 + Cl2 h ν → C6H5-CH2-Cl + HCl
c) homológy benzénu v prítomnosti katalyzátora
C6H5-CH3 + Cl2 AlCl 3 → (orta zmes, pár derivátov) +HCl
2. Nitrácia (kyselinou dusičnou)
C6H6 + HO-N02 t, H2S04->C6H5-N02 + H20
nitrobenzén - vôňa mandle!
C6H5-CH3 + 3HO-N02 t, H2S04→ S H3-C6H2(N02)3 + 3H202,4,6-trinitrotoluén (tol, TNT)
Aplikácia benzénu a jeho homológov
benzén C6H6 je dobré rozpúšťadlo. Benzén ako prísada zlepšuje kvalitu motorového paliva. Slúži ako surovina na výrobu mnohých aromatických organických zlúčenín - nitrobenzén C 6 H 5 NO 2 (rozpúšťadlo, z ktorého sa získava anilín), chlórbenzén C 6 H 5 Cl, fenol C 6 H 5 OH, styrén atď.
toluén C 6 H 5 –CH 3 – rozpúšťadlo, používané pri výrobe farbív, liečiv a výbušnín (TNT (TNT), alebo 2,4,6-trinitrotoluén TNT).
xylény C6H4(CH3)2. Technický xylén je zmesou troch izomérov ( orto-, meta- A pár-xylény) – používa sa ako rozpúšťadlo a východiskový produkt pri syntéze mnohých organických zlúčenín.
izopropylbenzén C6H5-CH(CH3)2 sa používa na výrobu fenolu a acetónu.
Chlórované deriváty benzénu používa sa na ochranu rastlín. Produktom nahradenia atómov H v benzéne atómami chlóru je teda hexachlórbenzén C 6 Cl 6 - fungicíd; používa sa na suché ošetrenie semien pšenice a raže proti sneťovitá. Produktom adície chlóru do benzénu je hexachlórcyklohexán (hexachlóran) C 6 H 6 Cl 6 - insekticíd; používa sa na ničenie škodlivého hmyzu. Uvedené látky patria medzi pesticídy – chemické prostriedky na boj proti mikroorganizmom, rastlinám a živočíchom.
styrén C 6 H 5 – CH = CH 2 veľmi ľahko polymerizuje, pričom vzniká polystyrén a pri kopolymerizácii s butadiénom styrén-butadiénové kaučuky.
VIDEO ZÁŽITKY
Arény alebo aromatické(benzenoidné) uhľovodíky sú zlúčeniny, ktorých molekuly obsahujú stabilné cyklické skupiny atómov (benzénové kruhy) s uzavretým systémom konjugovaných väzieb.
Aromatický charakter arénov sa vysvetľuje elektrónovou štruktúrou benzénového kruhu.
Kritériá aromatizácie. Na základe štúdia cyklických konjugovaných systémov sa zistilo, že zlúčenina je aromatická, ak poslúcha Hückelovo pravidlo: Zvýšenú termodynamickú stabilitu (aromatickosť) majú iba monocyklické konjugované systémy (polyény), ktoré majú rovinnú štruktúru a obsahujú 4n + 2 -elektróny v uzavretom konjugačnom reťazci (kde n je celé číslo: 0, 1, 2, 3, atď.). Prstence obsahujúce 4n -elektróny sú antiaromatické (destabilizované).
Aromatické podmienky Plne tomu zodpovedá molekula benzénu C 6 H 6, v ktorej konjugačnom systéme je zapojených 6 -elektrónov - aromatický sextet (podľa vzorca 4n + 2 s n = 1). Aromatické kruhy sú oveľa stabilnejšie ako ich konjugované acyklické analógy s rovnakým počtom π-elektrónov, t.j. benzén je stabilnejší ako CH2=CH–CH=CH–CH=CH2 (hexatrién-1,3,5).
Nomenklatúra. Vo veľkej miere sa používajú triviálne názvy (toluén, xylén, kumén atď.). Systematické názvy homológov benzénu sú konštruované z názvu uhľovodíkového radikálu (predpona) a slova benzén (koreň): C 6 H 5 - CH 3 - metylbenzén (toluén), C 6 H 5 - C 2 H 5 - etylbenzén, C 6 H 5 - CH (CH 3) 2 – izopropylbenzén (kumén). Ak existujú dva alebo viac radikálov, ich poloha je označená počtom atómov uhlíka v kruhu, s ktorým sú spojené. Číslovanie kruhu sa vykonáva tak, aby počet radikálov bol najmenší.
Pre disubstituované benzény RC 6 H 4 R sa používa aj iný spôsob konštrukcie názvov, pri ktorom sa poloha substituentov uvádza pred triviálnym názvom zlúčeniny s predponami: orto-(o-) substituenty na susednom uhlíku. atómov kruhu, t.j. v polohe 1,2-; meta-(m-) substituenty cez jeden atóm uhlíka (1,3-); para- (p-) substituenty na opačných stranách (1,4-).
izomerizmus. V sérii homológov benzénu sa objavuje štruktúrna izoméria: 1) polohy substituentov pre di-, tri- a tetra-substituované benzény (napríklad o-, m- a p-xylény); 2) uhlíkový skelet v bočnom reťazci obsahujúcom aspoň 3 atómy uhlíka (C6H5-CH2CH2CH3-n-propylbenzén a C6H5-CH(CH3)2-izopropylbenzén alebo kumén); 3) izoméria substituentov R, počnúc R = C 2 H 5 (napríklad molekulovému vzorcu C 8 H 10 zodpovedajú 4 izoméry: o-, m-, p-xylény CH 3 C 6 H 4 CH 3 a etylbenzén C 6 H 5 C 2 H 5); 4) medzitriedna izoméria s nenasýtenými zlúčeninami (napríklad vzorec C6H6 okrem benzénu
majú zlúčeniny CH 2 =CH–C≡C–CH=CH2, CH≡C–CH=CH–CH=CH2 atď., ako aj nenasýtené cykly). V substituovaných arénoch neexistuje priestorová izoméria vo vzťahu k benzénovému kruhu.
Hückelovo pravidlo:
Molekuly, ktoré dodržiavajú Hückelovo pravidlo, sú aromatické: planárny monocyklický konjugovaný systém obsahujúci (4n + 2)π-elektróny (kde n = 0,1,2...) je aromatický.
Mechanizmus elektrofilnej substitúcie:
11. fáza: tvorba p-komplexu. V tomto prípade sa medzi p-elektrónovým oblakom benzénového kruhu a elektrofilným činidlom vytvorí slabá väzba s nedostatkom elektrónovej hustoty pri zachovaní aromatického sexteta. Elektrofilné činidlo je zvyčajne umiestnené kolmo na rovinu kruhu pozdĺž jeho osi symetrie. Táto fáza prebieha rýchlo a neovplyvňuje rýchlosť reakcie. Existencia p-komplexu je dokázaná UV spektroskopiou...
2. fáza: tvorba b-komplexu. Táto fáza je pomalá a prakticky nezvratná. Medzi elektrofilom a atómom uhlíka benzénového kruhu sa vytvorí kovalentná b-väzba a atóm uhlíka prechádza zo spI do spI-valentného stavu s porušením aromatického sextetu a vytvorením cyklohexadienylového katiónu (benzéniový ión). Benzénový katión spolu s protiiónom tvoria iónovú zlúčeninu, ktorá dobre vedie elektrický prúd. V benzénovom ióne sú všetky atómy uhlíka umiestnené v rovnakej rovine a substituenty ysp-hybridizovaného atómu uhlíka sú naň kolmé.
3. a 4. stupeň: tvorba druhého p-komplexu a aromatizácia. B-komplex môže byť premenený na nový, mierne stabilný p-komplex, ktorý je deprotonovaný pod vplyvom bázy, zvyčajne protiiónu.
Benzén ako zástupca arén. Štruktúra molekuly benzénu. Konjugácia Pi-väzby. Izoméria a nomenklatúra arén. Benzénové homológy. Príprava arénov, ich fyzikálne vlastnosti
A RENES (aromatické uhľovodíky)
- Arény alebo aromatické uhľovodíky sú zlúčeniny, ktorých molekuly obsahujú stabilné cyklické skupiny atómov (benzénové jadrá) s uzavretým systémom konjugovaných väzieb.
Najjednoduchší zástupcovia (jednojadrové arény):
Viacjadrové arény: naftalén C10H8 antracén C14N10 atď.Pojem „aromatické zlúčeniny“ vznikol už dávno kvôli skutočnosti, že niektorí predstavitelia tejto série látok majú príjemnú vôňu. V súčasnosti má však pojem „aromatika“ úplne iný význam.Aromatickosť molekuly znamená jej zvýšenú stabilitu v dôsledku delokalizácie π-elektrónov v cyklickom systéme.Kritériá aromatizácie arénu:
- Atómy uhlíka v hybridizovanom stave sp2 tvoria cyklický systém.
- Atómy uhlíka sú umiestnené v rovnakej rovine (cyklus má plochú štruktúru).
- Uzavretý systém konjugovaných spojení obsahuje
- 4n+2π elektróny ( n– celé číslo).
Molekula benzénu plne spĺňa tieto kritériá. C6H6.
1. Štruktúra benzénu
benzén C6H6– predchodca aromatických uhľovodíkov.
Každý zo šiestich atómov uhlíka v jeho molekule je v stave hybridizácie sp2 a je spojený s dvoma susednými atómami uhlíka a atómom vodíka tromi σ väzbami. Väzbové uhly medzi každým párom π väzieb sú 120°. Kostra σ väzieb je teda pravidelný šesťuholník, v ktorom všetky atómy uhlíka a všetky σ väzby C–C a C–H ležia v rovnakej rovine:
P-elektróny všetkých atómov uhlíka navzájom interagujú bočným prekrytím susedných 2p-AO umiestnených kolmo na rovinu σ-skeletu benzénového kruhu. Tvoria jediný cyklický π-elektrónový oblak sústredený nad a pod rovinou prstenca.
Všetky väzby C–C v benzéne sú ekvivalentné, ich dĺžka je 0,140 nm, čo zodpovedá strednej hodnote medzi dĺžkou jednoduchej väzby (0,154 nm) a dvojitej väzby (0,134 nm). To znamená, že v molekule benzénu nie sú žiadne čisto jednoduché a dvojité väzby medzi atómami uhlíka (ako vo vzorci navrhnutom v roku 1865 nemeckým chemikom F. Kekulem) a všetky sú zarovnané (delokalizované, pozri animáciu). Preto je štruktúrny vzorec benzénu znázornený ako pravidelný šesťuholník (σ-kostra) a kruh vo vnútri, ktorý označuje delokalizované π-väzby:
Vzorec Kekule sa tiež často používa, ale berie sa do úvahy, že iba podmienečne prenáša štruktúru molekuly.
2. Benzénové homológy. Nomenklatúra a izoméria
Benzénové homológy sú zlúčeniny vytvorené nahradením jedného alebo viacerých atómov vodíka v molekule benzénu uhľovodíkovými radikálmi (R):
Všeobecný vzorec homologického radu benzénuCnH2n-6(n ≥ 6).
Nomenklatúra. Vo veľkej miere sa používajú triviálne názvy (toluén, xylén, kumén atď.). Systematické názvy sú zostavené z názvu uhľovodíkového radikálu (predpony) a slova benzén(koreň):
C6H5-CH3 C6H5-C2H5C6H5-C3H7
metylbenzén (toluén) etylbenzén propylbenzén
Ak existujú dva alebo viac radikálov, ich poloha je označená počtom atómov uhlíka v kruhu, ku ktorému sú viazané. Číslovanie kruhu sa vykonáva tak, aby počet radikálov bol najmenší. Napríklad:
Pre disubstituované benzény R-C6H4-R Používa sa aj iný spôsob vytvárania názvov, pri ktorom sa poloha substituentov uvádza pred triviálnym názvom zlúčeniny s predponami:
orto- (O-) substituenty na susedných uhlíkových atómoch kruhu, t.j. 1,2-;
meta- (m-) substituenty cez jeden atóm uhlíka (1,3-);
pár- (n-) substituenty na opačných stranách kruhu (1,4-).
Aromatické jednomocné radikály majú spoločný názov „ aryl". Dve z nich sú najbežnejšie v názvosloví organických zlúčenín: C6H5- (fenyl) A C6H5CH2- (benzyl).
izomerizmus(štrukturálne):
1) pozície poslancov Pre di-, tri- A tetra- substituované benzény (napr. O-, m- A n-xylény);
2) uhlíkový skelet v bočnom reťazci obsahujúci aspoň 3 atómy uhlíka:
3) izoméria substituentov R, počnúc R - C2H5.
Napríklad molekulový vzorec C8H10 4 izoméry zodpovedajú:
tri xylény CH3-C6H4-CH3 (o-, m-, p-) a etylbenzén C6H5-C2H5.
V alkylbenzénoch neexistuje priestorová izoméria vo vzťahu k benzénovému kruhu.
Príprava aromatických uhľovodíkov
Hlavnými prírodnými zdrojmi aromatických uhľovodíkov sú uhlia a ropy.
Reakcie na výrobu arénov naznačujú vzťah medzi rôznymi skupinami uhľovodíkov a možnosť ich vzájomnej premeny.