Koncept "benzenskega obroča" takoj zahteva dekodiranje. Da bi to naredili, je treba vsaj na kratko razmisliti o strukturi molekule benzena. Prvo strukturo benzena je leta 1865 predlagal nemški znanstvenik A. Kekule:
Najpomembnejši aromatski ogljikovodiki so benzen C 6 H 6 in njegovi homologi: toluen C 6 H 5 CH 3, ksilen C 6 H 4 (CH 3) 2 itd.; naftalen C 10 H 8, antracen C 14 H 10 in njuni derivati.
Atomi ogljika v molekuli benzena tvorijo pravilen ploščat šestkotnik, čeprav ga običajno narišemo kot podolgovatega.
Strukturo molekule benzena je dokončno potrdila reakcija njenega nastanka iz acetilena. Strukturna formula prikazuje tri enojne in tri dvojne izmenjujoče se vezi ogljik-ogljik. Toda takšna slika ne odraža prave strukture molekule. V resnici so vezi ogljik-ogljik v benzenu enakovredne in imajo lastnosti, ki se razlikujejo od lastnosti enojnih ali dvojnih vezi. Te značilnosti so razložene z elektronsko zgradbo molekule benzena.
Elektronska struktura benzena
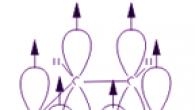
Vsak atom ogljika v molekuli benzena je v stanju sp 2 hibridizacije. S tremi σ vezmi je povezan s sosednjima atomoma ogljika in atomom vodika. Rezultat je raven šesterokotnik: vseh šest ogljikovih atomov in vse σ-vezi C-C in C-H ležijo v isti ravnini. Elektronski oblak četrtega elektrona (p-elektron), ki ni vključen v hibridizacijo, ima obliko ročice in je usmerjen pravokotno na ravnino benzenskega obroča. Takšni p-elektronski oblaki sosednjih ogljikovih atomov se prekrivajo nad in pod ravnino obroča.

Posledično šest p-elektronov tvori skupni elektronski oblak in eno samo kemično vez za vse ogljikove atome. Dve regiji velike elektronske ravnine se nahajata na obeh straneh ravnine vezi σ.

Oblak p-elektronov povzroči zmanjšanje razdalje med ogljikovimi atomi. V molekuli benzena so enaki in enaki 0,14 nm. V primeru enojne in dvojne vezi bi bile te razdalje 0,154 oziroma 0,134 nm. To pomeni, da v molekuli benzena ni enojnih ali dvojnih vezi. Molekula benzena je stabilen šestčlenski cikel enakih skupin CH, ki ležijo v isti ravnini. Vse vezi med ogljikovimi atomi v benzenu so enakovredne, kar določa značilne lastnosti benzenovega obroča. To najbolj natančno odraža strukturna formula benzena v obliki pravilnega šesterokotnika s krogom znotraj (I). (Krog simbolizira enakovrednost vezi med ogljikovimi atomi.) Vendar pa se pogosto uporablja tudi Kekuléjeva formula, ki označuje dvojne vezi (II):

Benzenov obroč ima določen niz lastnosti, ki se običajno imenuje aromatičnost.
Homologne vrste, izomerija, nomenklatura
Običajno lahko arene razdelimo v dve vrsti. Prvi vključuje derivate benzena (na primer toluen ali bifenil), drugi vključuje kondenzirane (polinuklearne) arene (najenostavnejši med njimi je naftalen):

Homologna vrsta benzena ima splošno formulo C n H 2 n -6. Homologe lahko obravnavamo kot derivate benzena, v katerih je eden ali več atomov vodika nadomeščenih z različnimi radikali ogljikovodikov. Na primer C 6 H 5 -CH 3 - metilbenzen ali toluen, C 6 H 4 (CH 3) 2 - dimetilbenzen ali ksilen, C 6 H 5 -C 2 H 5 - etilbenzen itd.

Ker so vsi ogljikovi atomi v benzenu enakovredni, njegov prvi homolog, toluen, nima izomerov. Drugi homolog, dimetilbenzen, ima tri izomere, ki se razlikujejo po relativni razporeditvi metilnih skupin (substituentov). To je orto- (skrajšano o-) ali 1,2-izomer, v katerem se substituenti nahajajo na sosednjih ogljikovih atomih. Če sta substituenta ločena z enim atomom ogljika, potem gre za meta- (skrajšano m-) ali 1,3-izomer, če sta ločena z dvema atomoma ogljika, pa je to para- (skrajšano p-) oz. 1,4-izomer. V imenih so substituenti označeni s črkami (o-, m-, p-) ali številkami.

Fizikalne lastnosti
Prvi člani homologne vrste benzena so brezbarvne tekočine s specifičnim vonjem. Njihova gostota je manjša od 1 (lažja od vode). Netopen v vodi. Benzen in njegovi homologi so sami po sebi dobra topila za številne organske snovi. Arene gorijo z dimljenim plamenom zaradi visoke vsebnosti ogljika v njihovih molekulah.
Kemijske lastnosti
Aromatičnost določa kemijske lastnosti benzena in njegovih homologov. Šestelektronski π sistem je stabilnejši od navadnih dvoelektronskih π vezi. Zato so adicijske reakcije manj pogoste za aromatske ogljikovodike kot za nenasičene ogljikovodike. Najbolj značilne reakcije za arene so substitucijske reakcije. Tako aromatski ogljikovodiki po svojih kemijskih lastnostih zasedajo vmesni položaj med nasičenimi in nenasičenimi ogljikovodiki.
I. Nadomestne reakcije
1. Halogeniranje (s Cl 2, Br 2)

2. Nitriranje

3. Sulfoniranje

4. Alkilacija (nastanejo homologi benzena) – Friedel-Craftsove reakcije

Alkilacija benzena se pojavi tudi, ko reagira z alkeni:

Stiren (vinilbenzen) se pridobiva z dehidrogenacijo etilbenzena:

II. Adicijske reakcije
1. Hidrogeniranje

2. Kloriranje

III. Oksidacijske reakcije
1. Zgorevanje
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Oksidacija pod vplivom KMnO 4, K 2 Cr 2 O 7, HNO 3 itd.
Ne pride do kemične reakcije (podobno kot pri alkanih).
Lastnosti homologov benzena
V homologih benzena ločimo jedro in stransko verigo (alkilni radikali). Kemijske lastnosti alkilnih radikalov so podobne alkanom; vpliv benzenovega obroča nanje se kaže v tem, da pri substitucijskih reakcijah vedno sodelujejo vodikovi atomi pri ogljikovem atomu, ki je neposredno vezan na benzenov obroč, pa tudi v lažji oksidaciji C-H vezi.

Učinek elektrodonorskega alkilnega radikala (na primer -CH 3) na benzenski obroč se kaže v povečanju efektivnih negativnih nabojev na ogljikovih atomih v orto in para legah; posledično je olajšana zamenjava povezanih vodikovih atomov. Zato lahko homologi benzena tvorijo trisubstituirane produkte (in benzen običajno tvori monosubstituirane derivate).
Fizikalne lastnosti
Benzen in njegovi najbližji homologi so brezbarvne tekočine s specifičnim vonjem. Aromatski ogljikovodiki so lažji od vode in se v njej ne raztopijo, zlahka pa se raztopijo v organskih topilih - alkoholu, etru, acetonu.
Benzen in njegovi homologi so sami po sebi dobra topila za številne organske snovi. Vse arene gorijo z dimnim plamenom zaradi visoke vsebnosti ogljika v njihovih molekulah.
Fizikalne lastnosti nekaterih aren so predstavljene v tabeli.
Tabela. Fizikalne lastnosti nekaterih aren
|
Ime |
Formula |
t°.pl., |
t°.b.p., |
|
Benzen |
C6H6 |
5,5 |
80,1 |
|
Toluen (metilbenzen) |
C 6 H 5 CH 3 |
95,0 |
110,6 |
|
Etilbenzen |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
ksilen (dimetilbenzen) |
C 6 H 4 (CH 3) 2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
par- |
13,26 |
138,35 |
|
|
propilbenzen |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Kumen (izopropilbenzen) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
stiren (vinilbenzen) |
C6H5CH=CH2 |
30,6 |
145,2 |
Benzen – nizko vrelišče ( tbala= 80,1 °C), brezbarvna tekočina, netopna v vodi
Pozor! Benzen – strup, vpliva na ledvice, spremeni formulo krvi (pri dolgotrajni izpostavljenosti), lahko moti strukturo kromosomov.
Večina aromatskih ogljikovodikov je smrtno nevarnih in strupenih.
Priprava arenov (benzen in njegovi homologi)
V laboratoriju
1. Fuzija soli benzojske kisline s trdnimi alkalijami
C6H5-COONa + NaOH t → C 6 H 6 + Na 2 CO 3
natrijev benzoat
2. Wurtz-Fittingova reakcija: (tukaj je G halogen)
C 6H 5 -G + 2Na + R-G →C 6 H 5 - R + 2 NaG
Z 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
V industriji
- izoliran iz nafte in premoga s frakcijsko destilacijo in reformiranjem;
- iz premogovega katrana in koksarniškega plina
1. Dehidrociklizacija alkanov z več kot 6 ogljikovimi atomi:
C6H14 t , kat→C 6 H 6 + 4H 2
2. Trimerizacija acetilena(samo za benzen) – r. Zelinsky:
3S 2 H 2 600°C, ukrepaj. premog→ C 6 H 6
3. Dehidrogenacija cikloheksan in njegovi homologi:
Sovjetski akademik Nikolaj Dmitrijevič Zelinski je ugotovil, da benzen nastane iz cikloheksana (dehidrogenacija cikloalkanov).
C6H12 t, kat→C 6 H 6 + 3H 2

C6H11-CH3 t , kat→C 6 H 5 -CH 3 + 3H 2
metilcikloheksantoluen
4. Alkiliranje benzena(priprava homologov benzena) – r Friedel-Crafts.
C6H6 + C2H5-Cl t, AlCl3→C 6 H 5 -C 2 H 5 + HCl
kloroetan etilbenzen

Kemijske lastnosti arenov
jaz. OKSIDACIJSKE REAKCIJE
1. Zgorevanje (kadeči se plamen):
2C6H6 + 15O2 t→12CO 2 + 6H 2 O + Q
2. V normalnih pogojih benzen ne razbarva bromove vode in vodne raztopine kalijevega permanganata
3. Homologe benzena oksidiramo s kalijevim permanganatom (razbarvamo kalijev permanganat):
A) v kislem okolju do benzojske kisline
Ko so homologi benzena izpostavljeni kalijevemu permanganatu in drugim močnim oksidantom, se stranske verige oksidirajo. Ne glede na to, kako kompleksna je veriga substituenta, se ta uniči, z izjemo a-ogljikovega atoma, ki se oksidira v karboksilno skupino.
Homologi benzena z eno stransko verigo dajejo benzojsko kislino:
Homologi, ki vsebujejo dve stranski verigi, dajejo dibazične kisline:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Poenostavljeno :
C6H5-CH3+3O KMnO4→C 6 H 5 COOH + H 2 O
B) v nevtralnih in rahlo alkalnih do soli benzojske kisline
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
II. ADICIJSKE REAKCIJE (težji od alkenov)
1. Halogeniranje
C6H6+3Cl2 h ν → C6H6Cl6 (heksaklorocikloheksan - heksakloran)
2. Hidrogeniranje
C6H6 + 3H2 t , PtozNi→ C 6 H 12 (cikloheksan)
3. Polimerizacija
III. SUBSTITUCIJSKE REAKCIJE – ionski mehanizem (lažji od alkanov)
b) homologi benzena pri obsevanju ali segrevanju
Kemične lastnosti alkilnih radikalov so podobne alkanom. Atome vodika v njih zamenjajo halogeni z mehanizmom prostih radikalov. Zato v odsotnosti katalizatorja, pri segrevanju ali UV obsevanju pride do radikalne substitucijske reakcije v stranski verigi. Vpliv benzenskega obroča na alkilne substituente vodi do dejstva, da Vodikov atom je vedno nadomeščen pri ogljikovem atomu, ki je neposredno vezan na benzenski obroč (a-ogljikov atom).
1) C6H5-CH3 + Cl2 h ν → C 6 H 5 -CH 2 -Cl + HCl
c) homologi benzena v prisotnosti katalizatorja
C6H5-CH3 + Cl2 AlCl 3 → (orta mešanica, par derivatov) +HCl
2. Nitriranje (z dušikovo kislino)
C6H6 + HO-NO2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
nitrobenzen - vonj mandlji!
C6H5-CH3 + 3HO-NO2 t, H2SO4→ Z H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-trinitrotoluen (tol, TNT)
Uporaba benzena in njegovih homologov
Benzen C 6 H 6 je dobro topilo. Benzen kot dodatek izboljša kakovost motornega goriva. Služi kot surovina za proizvodnjo številnih aromatskih organskih spojin - nitrobenzena C 6 H 5 NO 2 (topilo, iz katerega se pridobiva anilin), klorobenzena C 6 H 5 Cl, fenola C 6 H 5 OH, stirena itd.
Toluen C 6 H 5 –CH 3 – topilo, uporablja se pri proizvodnji barvil, zdravil in eksplozivov (TNT (TNT) ali 2,4,6-trinitrotoluen TNT).
ksileni C6H4(CH3)2. Tehnični ksilen je zmes treh izomerov ( orto-, meta- In par-ksileni) – uporablja se kot topilo in začetni produkt za sintezo številnih organskih spojin.
izopropilbenzen C 6 H 5 –CH(CH 3) 2 se uporablja za proizvodnjo fenola in acetona.
Klorirani derivati benzena uporabljajo za varstvo rastlin. Tako je produkt zamenjave atomov H v benzenu z atomi klora heksaklorobenzen C 6 Cl 6 - fungicid; uporabljamo ga za suho obdelavo semen pšenice in rži proti saj. Produkt dodajanja klora benzenu je heksaklorocikloheksan (heksakloran) C 6 H 6 Cl 6 - insekticid; uporablja se za zatiranje škodljivih žuželk. Navedene snovi spadajo med pesticide – kemična sredstva za zatiranje mikroorganizmov, rastlin in živali.
Stiren C 6 H 5 – CH = CH 2 zelo enostavno polimerizira in tvori polistiren, pri kopolimerizaciji z butadienom pa stiren-butadienske gume.
VIDEO DOŽIVETJA
Areni ali aromatični(benzenoidni) ogljikovodiki so spojine, katerih molekule vsebujejo stabilne ciklične skupine atomov (benzenske obroče) z zaprtim sistemom konjugiranih vezi.
Aromatični značaj arenov je razložen z elektronsko zgradbo benzenskega obroča.
Kriteriji aromatičnosti. Na podlagi proučevanja cikličnih konjugiranih sistemov je bilo ugotovljeno, da je spojina aromatska, če ustreza Hücklovo pravilo: Povečano termodinamično stabilnost (aromatičnost) imajo le monociklični konjugirani sistemi (polieni), ki imajo planarno zgradbo in vsebujejo 4n + 2 -elektrona v zaprti konjugacijski verigi (kjer je n celo število: 0, 1, 2, 3, itd.). Obroči, ki vsebujejo 4n -elektronov, so antiaromatski (destabilizirani).
Pogoji aromatičnosti Popolnoma ustreza molekuli benzena C 6 H 6, v sistemu konjugacije je vključenih 6 -elektronov - aromatski sekstet (po formuli 4n + 2 z n = 1). Aromatični obroči so veliko bolj stabilni kot njihovi konjugirani aciklični analogi z enakim številom π-elektronov, tj. benzen je stabilnejši od CH 2 =CH–CH=CH–CH=CH 2 (heksatrien-1,3,5).
Nomenklatura. Pogosto se uporabljajo trivialna imena (toluen, ksilen, kumen itd.). Sistematična imena homologov benzena so sestavljena iz imena ogljikovodikovega radikala (predpona) in besede benzen (koren): C 6 H 5 - CH 3 - metilbenzen (toluen), C 6 H 5 - C 2 H 5 - etilbenzen, C 6 H 5 - CH (CH 3) 2 – izopropilbenzen (kumen). Če obstajata dva ali več radikalov, je njihov položaj označen s številom ogljikovih atomov v obroču, s katerim so povezani. Oštevilčenje obroča se izvede tako, da je število radikalov najmanjše.
Za disubstituirane benzene RC 6 H 4 R se uporablja tudi drug način sestave imen, pri katerem se položaj substituentov navede pred trivialnim imenom spojine s predponami: orto-(o-) substituenti na sosednjem ogljiku. atomov obroča, tj. v položaju 1,2-; meta-(m-) substituente preko enega ogljikovega atoma (1,3-); para- (p-) substituentov na nasprotnih straneh (1,4-).
Izomerija. V nizu homologov benzena se pojavi strukturna izomerija: 1) položaji substituentov za di-, tri- in tetra-substituirane benzene (na primer o-, m- in p-ksileni); 2) ogljikov skelet v stranski verigi, ki vsebuje vsaj 3 atome ogljika (C 6 H 5 -CH 2 CH 2 CH 3 - n-propilbenzen in C 6 H 5 -CH(CH 3) 2 - izopropilbenzen ali kumen); 3) izomerija substituentov R, začenši z R = C 2 H 5 (na primer, molekulska formula C 8 H 10 ustreza 4 izomerom: o-, m-, p-ksileni CH 3 C 6 H 4 CH 3 in etilbenzen C 6 H 5 C 2 H 5); 4) medrazredna izomerija z nenasičenimi spojinami (na primer formula C 6 H 6 razen benzena
imajo spojine CH 2 =CH–C≡C–CH=CH2, CH≡C–CH=CH–CH=CH2 itd., pa tudi nenasičene cikle). V substituiranih arenih ni prostorske izomerije glede na benzenski obroč.
Hücklovo pravilo:
Molekule, ki upoštevajo Hücklovo pravilo, so aromatične: ravninski monociklični konjugirani sistem, ki vsebuje (4n + 2)π-elektrona (kjer je n = 0,1,2 ...), je aromatski.
Mehanizem elektrofilne substitucije:
11. stopnja: tvorba p-kompleksa. V tem primeru nastane šibka vez med p-elektronskim oblakom benzenskega obroča in elektrofilnim reagentom s pomanjkanjem elektronske gostote ob ohranjanju aromatskega seksteta. Elektrofilni reagent se običajno nahaja pravokotno na ravnino obroča vzdolž njegove simetrične osi. Ta stopnja se pojavi hitro in ne vpliva na hitrost reakcije. Obstoj p-kompleksa je dokazan z UV spektroskopijo...
2. stopnja: tvorba b-kompleksa. Ta stopnja je počasna in praktično nepopravljiva. Med elektrofilom in ogljikovim atomom benzenskega obroča nastane kovalentna b-vez, ogljikov atom pa preide iz spI v spI-valentno stanje z razpadom aromatskega seksteta in tvorbo cikloheksadienilnega kationa (benzenijevega iona). Benzenov kation skupaj s protiionom tvori ionsko spojino, ki dobro prevaja električni tok. V benzenovem ionu se vsi ogljikovi atomi nahajajo v isti ravnini, substituenti ysp-hibridiziranega ogljikovega atoma pa so pravokotni nanjo.
3. in 4. stopnja: tvorba drugega p-kompleksa in aromatizacija. B-kompleks se lahko pretvori v nov, rahlo stabilen p-kompleks, ki se pod vplivom baze, običajno protiiona, deprotonira.
Benzen kot predstavnik arenov. Zgradba molekule benzena. Konjugacija pi-vezi. Izomerija in nomenklatura arenov. Homologi benzena. Priprava arenov, njihove fizikalne lastnosti
A RENES (aromatski ogljikovodiki)
- Areni ali aromatski ogljikovodiki so spojine, katerih molekule vsebujejo stabilne ciklične skupine atomov (benzenova jedra) z zaprtim sistemom konjugiranih vezi.
Najenostavnejši predstavniki (enojedrne arene):
Večjedrne arene: naftalen C 10 H 8, antracen C 14 N 10 itd.Izraz "aromatske spojine" je nastal že dolgo nazaj zaradi dejstva, da imajo nekateri predstavniki te serije snovi prijeten vonj. Vendar pa ima dandanes pojem "aromatičnost" popolnoma drugačen pomen.Aromatičnost molekule pomeni njeno povečano stabilnost zaradi delokalizacije π-elektronov v cikličnem sistemu.Merila aromatičnosti Arene:
- Atomi ogljika v sp 2 hibridiziranem stanju tvorijo ciklični sistem.
- Ogljikovi atomi se nahajajo v isti ravnini (cikel ima ravno strukturo).
- Zaprt sistem konjugiranih povezav vsebuje
- 4n+2π elektronov ( n– celo število).
Molekula benzena popolnoma izpolnjuje ta merila. C 6 H 6.
1. Zgradba benzena
Benzen C 6 H 6– prednik aromatskih ogljikovodikov.
Vsak od šestih atomov ogljika v svoji molekuli je v stanju sp 2 hibridizacije in je povezan s sosednjima atomoma ogljika in atomom vodika s tremi vezmi σ. Vezni koti med vsakim parom π vezi so 120°. Tako je skelet vezi σ pravilen šestkotnik, v katerem vsi ogljikovi atomi in vse vezi σ C–C in C–H ležijo v isti ravnini:
P-elektroni vseh ogljikovih atomov medsebojno delujejo s stranskim prekrivanjem sosednjih 2p-AO, ki se nahajajo pravokotno na ravnino σ-skeleta benzenovega obroča. Tvorijo en sam ciklični oblak π-elektronov, koncentriran nad in pod ravnino obroča.
Vse C–C vezi v benzenu so enakovredne, njihova dolžina je 0,140 nm, kar ustreza vmesni vrednosti med dolžino enojne vezi (0,154 nm) in dvojne vezi (0,134 nm). To pomeni, da v molekuli benzena ni čisto enostavnih in dvojnih vezi med ogljikovimi atomi (kot v formuli, ki jo je leta 1865 predlagal nemški kemik F. Kekule), in so vse poravnane (delokalizirane, glej animacijo). Zato je strukturna formula benzena prikazana kot pravilni šesterokotnik (σ-skelet) in krog v njem, kar označuje delokalizirane π-vezi:
Pogosto se uporablja tudi formula Kekule, vendar se upošteva, da le pogojno prenaša strukturo molekule.
2. Homologi benzena. Nomenklatura in izomerija
Homologi benzena so spojine, ki nastanejo z zamenjavo enega ali več atomov vodika v molekuli benzena z radikali ogljikovodikov (R):
Splošna formula homologne serije benzenaCnH2n-6(n ≥ 6).
Nomenklatura. Pogosto se uporabljajo trivialna imena (toluen, ksilen, kumen itd.). Sistemska imena so zgrajena iz imena ogljikovodikovega radikala (predpona) in besede benzen(koren):
C6H5-CH3 C6H5-C2H5C6H5-C3H7
metilbenzen (toluen) etilbenzen propilbenzen
Če obstajata dva ali več radikalov, je njihov položaj označen s številom ogljikovih atomov v obroču, na katerega so vezani. Oštevilčenje obroča se izvede tako, da je število radikalov najmanjše. Na primer:
Za disubstituirane benzene R-C 6 H 4 -R Uporablja se tudi druga metoda konstruiranja imen, pri kateri je položaj substituentov naveden pred trivialnim imenom spojine s predponami:
orto- (O-) substituenti na sosednjih ogljikovih atomih obroča, tj. 1,2-;
meta- (m-) substituenti preko enega ogljikovega atoma (1,3-);
par- (n-) substituenti na nasprotnih straneh obroča (1,4-).
Aromatični monovalentni radikali imajo skupno ime " aril". Od teh sta dve najpogostejši v nomenklaturi organskih spojin: C6H5- (fenil) In C6H5CH2- (benzil).
Izomerija(strukturni):
1) položajih poslancev Za di-, tri- In tetra- substituirani benzeni (npr. O-, m- In n-ksileni);
2) ogljikov skelet v stranski verigi ki vsebuje vsaj 3 atome ogljika:
3) izomerija substituentov R, začenši z R - C 2 H 5.
Na primer, molekulska formula C 8 H 10 4 izomeri ustrezajo:
trije ksileni CH3-C6H4-CH3 (o-, m-, p-) in etilbenzen C6H5 -C2H5.
V alkilbenzenih ni prostorske izomerije glede na benzenski obroč.
Priprava aromatskih ogljikovodikov
Glavni naravni viri aromatskih ogljikovodikov so premog in nafta.
Reakcije za proizvodnjo arenov kažejo na razmerje med različnimi skupinami ogljikovodikov in možnost njihovega preoblikovanja drug v drugega.